|
Odpowiadając na Twoje pytanie, napiszę To co zamieściłem dzisiaj na innym forum.
Komunikat jest zachowawczy – tak, ale raczej inny być nie może. To, ze w ogóle wypuścili cos takiego w formie wyników cząstkowych, to dla mnie i tak wielka rzecz (ja nie pamiętam takiego case na rynku). Więc wypuścili to, czego do tej pory się nie praktykowało w otoczeniu jednych z najbardziej restrykcyjnych wymagań MAR-owskich pilnowanych do tego przez KNF. A jak coś będzie nie tak jak zakładali… Musza być ostrożni, ja tez bym był.
„Właśnie dlatego na tym etapie nie podajemy konkretnych wartości liczbowych, żeby nie dochodziło do niepoprawnych interpretacji. Możemy jedynie podzielić się refleksją, że z optymizmem patrzymy na najbliższą przyszłość – podsumowuje Wielgus”.
A wracając do sprawy – aby nam nie uciekł główny wątek. Bioceltix zrobił pilotaż badań przedklinicznych – w dokumencie informacyjnym, który pokazał się w związku z byłą emisją jest informacja, że w toku prac nad rozwojem produktu leczniczego BCX-CM-J (choroba zwyrodnieniowa stawów) spółka w 2020 roku przeprowadziła ocenę skuteczności na pacjentach klinicznych (psach tj. gatunku docelowym). Dam tylko jedno zdanie podsumujecie Biorąc pod uwagę przyjęte kryteria oceny skuteczności badanego produktu leczniczego Emitent otrzymał następujące wyniki: • w dniu 30: 19/26 psów uzyskało poprawę wyników leczenia, co dało 73% skuteczności stosowania badanego produktu leczniczego; • w dniu 60: 15/22 psów uzyskało poprawę wyników leczenia, co dało 68% skuteczności.”
Dodam, że regulator EMA zarejestrował leki konkurencji, przy skuteczności 43,5% (Librela) i 52% (Cytopoint).
Teraz mamy wyniki cząstkowe zasadniczych badań klinicznych. Więc mamy do analizy dość mocne dane z dwóch odrębnych badań- i tutaj każdy musi sobie odpowiedzieć jakie jest prawdopodobieństwo i co może się dalej podziać
|
|
W dzisiejszym PB ukazał się artykuł Zastrzyk kapitału dla weterynarzy www.pb.pl/gieldowi-weterynarze... A w nim ciekawe wypowiedzi nt. ceny ostatniej emisji oraz dalszych planów realizacji kamieni milowych.
|
|
Temat:
PURE
W czasie pisania tego teksu kurs Pure Biologics zaczął ocierać się o 90 zł, co dla wielu osób jest niepokojące, a w połączeniu z utrzymującą się od 1,5 roku konsolidacją ceny akcji w zakresie 75-135 z psychologicznego punktu widzenia bardzo trudne do wytrzymania. Gdybyśmy mieli do czynienia ze znaną firmą produkcyjna, z upowszechnionym produktem, dobrym zarządem oraz atrakcyjnym P/E np. w okolicach 5 dla wszystkich byłaby to okazja inwestycyjna. A tak – to spółka innowacyjna, wiele osób od dawna się zastanawia co z nią zrobić, może rynek tj. cena „wie lepiej”? Otrzymujemy bardzo dużo telefonów, bardzo dużo rozmawiamy ze znajomymi inwestorami – pytania zawsze są te same, co myślimy i czy dalej warto spółkę trzymać w portfelu. Spróbowaliśmy podsumować wszystko na podstawie posiadanej przez nas wiedzy i doświadczenia w oparciu na poprzednich tekstach. Zapraszamy do lektury.
Co robią i z czego korzystają, podstawowe informacje
Na początek trochę koniecznej powtórki – spółka rozwija swoje projekty w zakresie immunoonkologii – terapie mające skierować układ odpornościowy do walki z nowotworem oraz terapie pozaustrojowe wykorzysujące aptamery (sztucznie wyprodukowane krótkie fragmenty, zbudowane z tego samego materiału, co DNA). Imunoonkologia jest nową atrakcyjną ścieżką w onkologii, uznana już bezdyskusyjnie prze BigPharmę (co widać w cenach transakcyjnych terapii) ze względu na większe bezpieczeństwo dla pacjenta (minimalizowanie skutków ubocznych w odniesieniu do leków konwencjonalnych) oraz wykorzystanie naturalnych środków obronnych organizmu. Spółka dysponuje dobrze wyposażonym zapleczem laboratoryjno-biurowym o powierzchni ok. 1000 m2, w drugim kwartale 2022 roku planowane jest przeniesienie się do nowego, bardziej nowoczesnego laboratorium badawczego. Pure zatrudnia 80 pracowników naukowych, w blisko 40% ze stopniem doktora. Łącznie 86 specjalistów obsługuje bezpośrednio segment naukowo badawczy, a w sumie zatrudnionych jest 96 osób w oparciu o umowę o pracę. Jak zapewniają przedstawiciele spółki ich kompetencje pozwalają realizować wszystkie projekty rozwoju leków oraz terapeutycznych wyrobów medycznych od fazy wyboru celu molekularnego do fazy testów in vitro włącznie – w całości w oparciu o własne zasoby naukowe i technologiczne. Pozwala to na całkowitą niezależność od licencjonowania kandydatów na leki od innych podmiotów czy uczelni oraz usługowych firm zewnętrznych, możliwość kontroli i pełną poufność prowadzonych badań w ich początkowym, najbardziej wrażliwym momencie.
Spółka posiada własne platformy technologiczne do generowania cząstek do programów badawczych PureSelect2 (platforma do generowania białek i przeciwciał) oraz PureApta (platforma do generowania tzw. aptamerów, czyli sztucznie wygenerowanych łańcuchów DNA lub RNA przypominających przeciwciała). Z praktycznego punktu widzenia inwestora, pomijając możliwość wykonywania dość unikalnych zleceń kontraktowych na własnych platformach, wynika jedna o wiele ważniejsza sprawa – spółka realizując programy badawcze zaczyna zawsze od generowania cząstek: przeciwciał i aptamerów wykorzystują własną platformę. Jest to o wiele tańsze, prostsze i wielokrotnie lepsze rozwiązania od tych laboratoriów, których takich platform nie mają. Po pierwsze inne laboratoria muszą taką cząstkę zamówić – co zajmuje czas i kosztuje, po drugie, jeśli okaże w trakcie badań, że zamówione cząstki nie posiadają pożądanych właściwości trzeba się cofnąć i zamówić kolejne cząsteczki badawcze. To wszystko trwa i kosztuje, tutaj nie ma tego rodzaju problemu, bo platformy są ich własnością i to jest wielka wartość dodaną.
Jakie projekty rozwijają, na jakim są etapie – czyli kiedy możemy dojść do komercjalizacji?
Spółka w chwili obecnej posiada 3 projekty lekowe oparte na przeciwciałach: PB001 Multibody (rak jelita grubego i odbytu), PB003 PureActivator (niedrobnokomórkowy rak płuc), PB004 PureBike (potrójnie negatywny rak piersi) oraz 3 projekty (w tym dwa terapeutyczne) oparte na aptamerach : PB002 AptaPheresis, PB005 Apta-MG, PB006 Apta-MLN. Dodatkowo spółka prowadzi dwa konsorcjalne projekty naukowo-technologiczne PB007 (MARA), z partnerami ze środowisk akademickich z czterech krajów oraz PB008 (MAGGBRIS) – zakończony sukcesem w lipcu br. z partnerami z pięciu krajów europejskich.
Chcielibyśmy w tym miejscu podkreślić bardzo ważny (a raczej prawdopodobnie najważniejszy) cenotwórczy aspekt dla obu spółek, przyjęty jako konsensus wśród analityków. To rozwijane leki (oraz terapie aptamerowe dodatkowo w przypadku Pure Biologics) są główną wartością spółek i od stopnia ich rozwoju (a w konsekwencji możliwości komercjalizacji) w rzeczywistości zależy ich kapitalizacja.
PB001 MultiBody – w sierpniu br. nastąpiło zakończenie pierwszego badania przedklinicznego modelowej cząsteczki bispecyficznej projektu PB001. Testy prowadzone były na myszach z ludzkim układem odpornościowym. Nie zaobserwowano żadnych objawów ostrej toksyczności lub poważnych zmian histopatologicznych. Wykazano, że cząstka badana aktywuje układ odpornościowy, a spółka będzie kontynuował badania przedkliniczne w szerszym panelu.
To badanie było dla spółki bardzo ważne, bo istniało ryzyko (jak zawsze w przypadkach przejścia z laboratorium na organizmy żywe), że może wydarzyć się coś nieoczekiwanego na żywych zwierzętach, czego wcześniej nie dostrzeżono. Trzeba pamiętać, że to jest zupełni nowy typ cząsteczki (bispecyficznej), aktywujący dwa receptory, które nigdy nie były aktywowane. Od strony badawczej każda ingerencja w receptor sprawia, że w żywej komórce mogą zajść rożne procesy molekularne, negatywne dla organizmu. Ponadto kolejnym ryzykiem badania był fakt, że przeciwciała, które co do zasady mają wysoką selektywność tzn. przyłączają się celowanego receptora, mogą w organizmie żywym nie aktywować celu molekularnego, a inne elementy. Nic takiego nie nastąpiło i badanie przebiegło zgodnie z założeniami.
Co dalej – spółka zdeklarowała kontunuowanie badań w kolejnym, czyli w II panelu badań przedklinicznych. Zwykła praktyka w takich przypadkach podpowiada nam, że należy teraz pozyskać w odpowiedniej ilości zwierzęta do tych badań, a jednocześnie w laboratorium wykorzystując doświadczenie zebrane w fazie I badań przedklinicznych sprawdzać kolejne kombinacje cząstek. Ostatecznym wynikiem będzie wybranie optymalnych najlepszych cząstek tzw. leadów. Kiedy to nastąpi – my tego oczywiście nie wiemy, ale liczymy na rozpoczęcie badań II fazy najdalej za kilka miesięcy, wyciągając logiczny wniosek z wcześniej deklarowanej ciągłości badań i czasu przewidzianego dla całości badań przedklinicznych.
PB002 AptaPheresis – rozpoczęto fazę wstępną badania przedklinicznego, planowany czas trwania całego badania oszacowano na co najmniej dwa miesiące. Przypominamy, że w pierwszej części badań przedklinicznych są przeprowadzane specjalistyczne testy (w ciele zwierzęcia) patogennego przeciwciała anty-AQP4, żeby określić podstawowe warunki przeprowadzenia właściwego eksperymentu. Kolejnym etapem będą badania zasadnicze, w którym oceniona zostanie skuteczność usuwania powyższego białka patogennego przez aptamerowy filtr biomolekularny. Podwykonawcom zewnętrznym zlecono proces optymalizacji produkcji aptamerów w dużej skali, które posłużą m.in. do produkcji filtra biomolekularnego, który następnie zostanie wykorzystany w badaniach wewnętrznych, a także przedklinicznych na modelu zwierzęcym. Podwykonawcy przekazali już pierwsze partie aptamerów wykonane w średniej skali, które pozytywnie przeszły weryfikację.
Jednocześnie, jak czytamy w raporcie półrocznym, spółka przeprowadziła szereg rozmów z potencjalnymi podwykonawcami, do wytworzenia partii testowej filtrów. Proces wytworzenie pierwszych filtrów obejmował będzie m.in. pakowanie złoża z aptamerem do kolumny, zbadanie poziomu potencjalnego cieknięcia kolumny, przeprowadzenie testów sterylizacji, testów na obecność endotoksyn, a także testów mikrobiologicznych produktu końcowego.
Kiedy można się spodziewać przystąpienia do zasadniczych badan przedklinicznych? – wcześniejsze deklaracje spółki mówią nam, że powinno to nastąpić po zakończeniu wstępnych badan przedklinicznych.
Pozostałe projekty badawcze – PB003 PureActivator i PB004 PureBike
Nie będziemy o tym szczegółowo pisać. Prace w projektach trwają i patrząc po ich postępach najprawdopodobniej wejdą do przedkliniki w 2022r.
W kontekście komercyjnego wykorzystania projektów – chcielibyśmy napisać jeszcze o jednej sprawie
Wszyscy wiedzą, że w spółkach biotechnologicznych największe pieniądze są w programach lekowych. Te nadzieje i możliwe do pozyskania sumy rozgrzewają głowy inwestorów, ponieważ zawsze mają przełożenie na kapitalizację spółek. W przypadku Pure Biologics pisaliśmy nie raz o wyższości przeciwciał nad większością leków konwencjonalnych zarówno we wcześniejszej możliwej komercjalizacji jak i możliwych do uzyskania wyższych cen w transakcjach parteringowych. Jednak trzeba pamiętać, że rozwój leków trwa długo (nawet w fazie przedklnicznej), a na globalnym rynku leków takich podmiotów jak Pure Biologics jest sporo i jeżeli coś zostanie sprzedane musi pokazać bardzo solidne dane naukowe. Jednocześnie wiemy z raportów, że spółka posiada środki do kontynuowania badań i będzie się starała posunąć te badania jak najdalej, aby jak najlepsze rezultaty naukowe były podstawą zawarcia możliwie najlepszej umowy parteringowej. Zgodnie z raportem spółka obecnie planuje pierwsze wpływy z komercjalizacji po 2023r.
Pamiętajmy też o drugiej (poza przeciwciałami) „dywizji” rozwijanej przez spółkę, czyli aptamerach z najbardziej zaawansowanym projektem, czyli PB002 Aptapheresist. Kilkukrotnie w swoich artykułach opisywaliśmy ten (jak nam się wydaje) niedoceniony przez inwestorów, a rozwijany przez spółkę segment działalności. Pure Biologics jest regularnym uczestnikiem najważniejszych na świecie konferencji naukowych dotyczących aptamerów, gdzie również aktywnie przedstawia swoje badania. Zaryzykowalibyśmy stwierdzenie, że podmiotów zajmujących się praktycznym zastosowaniem aptamerów jest stosunkowo niewiele na świecie, a podmioty, które badają możliwości oczyszczania krwi z elementów patogennych (w procesie aferezy) z wykorzystaniem aptamerów nie są nam w ogóle znane. Jednocześnie wiemy, że tak naprawdę spółka tworzy platforma do wielorakich zastosowań (usuwania z krwi czynników patogennych) projekt AptaPheresist przeciera im tak naprawdę szlaki, a za nim „idzie” projekt PB005 AptaMG (miastenia rzekomoporaźna).
Pamiętamy, że spółka na swoich prezentacjach, mówiła nie raz, że chciałaby się uwiarygodnić przed rynkiem z partnerem zewnętrznym zarówno do inwestorów, jak i potencjalnych kontrahentów kolejnych „dealów”. Czy tak będzie i kiedy oraz co będzie pierwsze przeciwciała czy aptamery tego nie wiemy.
Transakcje referencyjne
Podstawowym elementem sprawdzającym dla spółki innowacyjnej jest, oczywiście, transakcja partneringowa i jej wartość. Trzeba zwrócić uwagę na fakt, iż bardzo trudno jest wyznaczyć jakąkolwiek przeciętną wartość tego typu umowy, ponieważ ich rozrzut jest ogromny. Wartość samej transakcji i jej szczegółowe warunki zależą od bardzo wielu czynników: udziału w kosztach, stopnia rozwoju cząsteczki lub technologii, ryzyka niepowodzenia, potencjału sprzedażowego itp. Jednak schemat jest w każdym przypadku bardzo zbliżony. Większość tego typu umów składa się ze stosunkowo niewielkiej płatności wstępnej (up-front), serii płatności wypłacanych za realizację określonych celów (milestones) oraz tantiem od sprzedaży potencjalnego leku.
Spółka na swoich prezentacjach wielokrotnie pokazywała wybrane transakcje referencyjne. Jak zapewnia, transakcje te były precyzyjnie dobrane pod względem podobieństwa i dotyczą bardzo podobnych obszarów terapeutycznych (immunoonkologia) oraz cząstek aktywnych leku jak rozwijane przez nich (np.: przeciwciała bispecyficzne jako cząstki aktywne leku w kategorii First-in-class). Podane wartości to od 15 mln euro (transakcja na początku fazy przedklinicznej) do 120 mln USD (transakcja przed pierwszą fazą kliniczną) jako upfront + 0,6 do 1,7 mld milestones + royalties /jedną cząsteczkę.
Pieniądze na badania
Wszystkie obecne projekty komercyjne będą realizowane do końca 2023r. Katalog projektów na dzisiaj jest zamknięty. Ostatnia emisja spółki była w grudniu 2020r, w których spółka pozyskała 54 mln zł. Spółka szacuje łączne nakłady potrzebne na zrealizowanie kluczowych projektów w latach 2020-2023 na ok. 130,4 mln zł, z czego 47,8 mln zł planuje sfinansować środkami pozyskanymi z ostatniej emisji, a pozostałą część środkami pochodzącymi z kolejnych transz dotacji oraz środkami własnymi pozyskanymi m.in. z bieżącej działalności spółki.
Programy motywacyjne
Spółka traktuje pracowników jako swój największy kapitał i trudno się z tym nie zgodzić, bo to oni są decydującym ogniwem sukcesu lub jego braku. Ludzi i to jak najlepszych, trzeba przyciągać lub jeśli już są zatrzymać i zmotywować. Wtedy spółki będą miały prawdopodobieństwo uzyskania jak najlepszych wyników prac i ich skomercjalizowania a kapitalizacja rynkowa jest oczywiście wyłącznie pochodną powyższych. W spółce są dwa programu motywacyjne.
Elementem pierwszego programu motywacyjnego jest 241 000 akcji własnych oddanych przez akcjonariuszy założycieli, którzy postanowili przeznaczyć część należących do nich akcji, nie obciążając tym samym pozostałych akcjonariuszy, czyli nie rozwadniając kapitału. Dotyczyło to aż 14,6% kapitalizacji spółki (przed ostatnią emisją) i stanowiły one ok. 26% akcji posiadanych przez akcjonariuszy założycieli. Program motywacyjny trwający od stycznia 2020r będzie realizowany do końca grudnia br, na akcje są podpisane obowiązujące w tym czasie umowy lock-up. Programem motywacyjnym objętych jest 81 pracowników spółki.
Spółka wprowadza drugi program motywacyjny, czyli 118 500 warrantów, co stanowi 5% kapitalizacji spółki. Osobami uprawnionymi do udziału w programie będą członkowie zarządu oraz osoby uznane za kluczowe dla działalności spółki. Jako osoby kluczowe wskazano m.in. nowego dyrektora naukowego oraz dyrektora medycznego, którego zatrudnienie jest planowane. Dla tych osób prawo do objęcia warrantów powstanie wraz z postępem prac badawczych m.in.: przejścia projektów przez kolejne części badań przedklinicznych oraz klinicznych. Dla członków zarządu uczestniczących w programie prawo to będzie uzależnione m.in. wzrostem kapitalizacji spółki. Warranty będą systematyczne przyznawane w czasie trwania całego programu motywacyjnego liczonego na ok. 2,5 roku, a objecie akcji nastąpi – 11.2023-12.2023 + dodatkowy 12-miesięczny lock-up licząc do tej daty.
Wiarygodność
Analitycy, którzy oceniają spółki innowacyjne podobnie jak my w swoich analizach, coraz większą uwagę zwracają na ludzi, którzy są najcenniejszym aktywem każdej firmy na wczesnym etapie rozwoju. To najważniejszy element powtarzany przez nas przez lata i jeden z głównych czynników brany przez nas pod uwagę przy wycenie spółek innowacyjnych. Moglibyśmy w tym miejscu pisać o międzynarodowym zespole i o ich kompetencjach, ale napiszemy wyłącznie o ostatnim „nabytku” Pure, dyrektorze naukowym Dr Pieter Spee – biolog medyczny i menadżer z wieloletnim doświadczeniem w międzynarodowych firmach biofarmaceutycznych, został powołany na stanowisko w Pure Biologics. Jak czytamy na stronie spółki „dr Pieter Spee wnosi obszerną wiedzę merytoryczną o procesie rozwoju leków biologicznych oraz bardzo szerokie kompetencje z obszaru immunoonkologii, w szczególności dotyczące komórkowych mechanizmów odpornościowych, a także doświadczenie w zarządzaniu zespołami naukowców jak i procesami badawczo-rozwojowymi w nauce”. Nowy dyrektor naukowy spółki będzie odpowiadał za całość koncepcji naukowych i realizowanych projektów, a także wspierał proces nawiązania międzynarodowych kontaktów biznesowych z partnerami z branży farmaceutycznej. Dlatego też uważamy, że może być to traktowane jako jeden z elementów wiarygodności spółki, ponieważ tacy ludzie nie przychodzą do przypadkowych spółek, przez całe życie budują swoją pozycję w branży, mogą pracować na całym świecie i na równi z pieniędzmi liczy się dla nich rozwijany produkt i pozycja firmy.
W planach strategicznych spółki poza nowym dyrektorze naukowym planowany jest odniesieniu do dyr. medycznego – planowany jest proces rekrutacji realizowany, podobnie jak w przypadku dyr. naukowego, na rynku międzynarodowym. Celem spółki jest, aby dyrektor medyczny zjawiłby się mniej więcej rok przez pierwszym planowanym wprowadzeniem programu badawczego do badań klinicznych.
Przy okazji, chcielibyśmy zwrócić uwagę na element, niesłychanie ważny, a nierozumiany dla osób spoza branży. Gdy spółka biotechnologiczna zbliża się do pewnego określonego punktu swojego rozwoju, gdzie zaczynają się konkretne rozmowy z przedstawicielami Big Pharmy, zawsze pojawia się element wiarygodności oraz kooperacji przyszłych partnerów. Najistotniejszą częścią umowy nie jest wydanie przez dużą firmę farmaceutyczną 20 lub 50 mln dolarów, jako opłatę wstępną, tylko prawdopodobieństwo przechodzenia cząsteczki przez kolejne fazy kliniczne, których koszt to kilkudziesięciokrotność upfrontu. Problemy naukowe i technologiczne mogą się pojawić na każdym etapie badań i Bigpharma musi mieć po drugiej stronie rozpoznawalne w środowisku osoby, mające historycznie sukcesy przy rozwoju cząstek. Głęboko wierzymy, że polscy naukowcy szybko zdobędą taka pozycję, jednakże wcześniej muszą przejść przez rozwój kilku cząstek do procesu rejestracji włącznie. Jak piszemy, to prawdopodobnie kwestia czasu, ale do tej pory, aby zwiększyć swoje szanse, trzeba takie kompetencje i wiarygodność, po prostu, wynająć z rynku. I takim naukowcem jest dr Peter Spee, współautor 7 patentów w obszarze przeciwciał i kilkudziesięciu publikacji naukowych, pracujący w wielu firmach na całym świecie m.in. Novo Nordisk – jednej z największych światowych firm farmaceutycznych.
Innym elementem wiarygodności jest naszym zdaniem umowa Umowa z Twist Bioscience.
Spółka nawiązała współprace z amerykańską firmą Twist Bioscience (notowana na Nasdaq, market cap. 5,5 mld USD). Umowa zakłada udzielenie Pure Biologics dostępu do wybranych bibliotek przeciwciał, zoptymalizowanych z wykorzystaniem najnowocześniejszych rozwiązań, w tym sztucznej inteligencji i big data. Pure Biologics zapłaci Twistowi roczną opłatę licencyjną za dostęp do technologii oraz poniesie opłaty za rozwój przeciwciał powstałych w wyniku współpracy (przedklinicznej, klinicznej czy komercyjnej).
Twist Bioscience Corporation została umieszczona na prestiżowej corocznej liście Fast Company najbardziej innowacyjnych firm na świecie (MIC) na rok 2021. Tegoroczna lista MIC obejmuje 463 firmy z 29 krajów. Twist, ze względu na swoją pozycję rynkową wybiera precyzyjnie swoich klientów do wspólnej współpracy, weryfikując ich potencjał i dotychczasowy dorobek naukowy. Stąd wypowiedzi prezesów obu spółek z okazji zawarcia umowy oraz w jednakowym czasie informacje na GWP i NASDAQ.
Wycena spółki dokonana przez BM BOŚ
W maju br. został opublikowany raport analityczny Domu Maklerskiego BOŚ przygotowanym przez Sylwię Jaśkiewicz. Obecny raport oficjalnie włącza Pure Biologics do grona pokrywanych przez DM BOŚ spółek. Odbieramy to bardzo pozytywnie, ponieważ większość mniejszych podmiotów na rynku nie ma pokrycia analitycznego, co jest bardzo widoczne, w szczególności w tak trudnych branżach jak biotechnologia. Sylwia Jaśkiewicz niewątpliwie ma kompetencje, jako jedna z bardzo niewielu profesjonalnych analityków, aby taki raport napisać i zrobiła to znakomicie. To jeden z najlepszych raportów analitycznych, jakie czytaliśmy w ogóle, a z polskiej biotechnologii bezdyskusyjnie najlepszy raport. Dokument jest bardzo obszerny i porusza właściwie każdy aspekt działalności spółki, a ilość podanych danych, transakcji referencyjnych, opisy konkurencji, rynku itp. jest zdumiewająca. Myślimy, że inwestor może tam znaleźć odpowiedź na praktycznie każde pytanie dotyczące część naukowej lub biznesowej spółki. W raporcie znajdziemy rekomendację długoterminową fundamentalną Kupuj oraz krótkoterminową relatywną Przeważaj, z wyceną w horyzoncie 12-miesięcy wynoszącą 169,8 zł na akcję.
Jak pisaliśmy wcześniej wycena to kawał dobrej roboty analitycznej, jednak w naszej osobistej opinii została wykonana dość ostrożnie z założonymi odległymi możliwymi umowami itp. W odniesieniu do podanych w raporcie procentów prawdopodobieństwa powodzenia danego projektu, warto zwróć uwagę, na jeden z najważniejszych, jak się wydaje, wniosków. W analizie inwestorskiej nie należy opierać się na całościowym prawdopodobieństwie zakończenia projektu rozumianego jako rejestracja leku, ponieważ zdecydowana większość umów w lekach biologicznych jest podpisywana w fazie przedklinicznej. To przecież na tę potencjalną umowę wszyscy czekają i to właśnie ona podniesie kapitalizację z obecnych 200 mln kapitalizacji na poziom konkurencji obecnej na polskim rynku, a tutaj prawdopodobieństwo sukcesu (fazy przedklinicznej, gdzie jest już pierwszy projekt PB001, a kolejne będą systematycznie wchodziły) wynosi 69% dla jednego projektu (i wcale nie trzeba zakładać wprowadzenia leku do sprzedaży). To oczywiście tylko statystyka, ale przy tylu rozwijanych projektach, jako możliwy zysk/ryzyka, bardzo ciekawa.
W tym miejscu warto przypomnieć o generalnej zasadzie wzrostu cen akcji w dniach ogłoszenia transakcji: Według analiz HBM Partners, średni wzrost cen akcji w dniu ogłoszenia transakcji w 2019 wyniósł prawie 100%, co ciekawe stwierdzono również, że w latach 2015-2019 wzrost był wyższy w przypadku mniejszych, a mniejszy w przypadku większych transakcji. Również na naszym polskim podwórku ostatnio tego typu transakcja miała miejsce – OncoArendi Therapeutics podpisało umowę z belgijskim Galapagos.
Porównanie z Captor Therapeutics
W kwietniu br. dokonaliśmy porównania z Captor Therapeutics, którego kapitalizacja wynosi blisko 800 mln zł. Tutaj można przeczytać.
Ryzyka
Ryzyka w spółce biotechnologicznej – oczywiście, że są. Najważniejsze z ryzyk naszym zdaniem to:
• nieprzejście poszczególnych programów badawczych do kolejnych etapów
• brak finansowania
• odejście kluczowych osób
• trudności w pozyskaniu partnera w dalszym rozwijaniu cząstek
Ale trzeba też pamiętać, że powyższymi ryzykami spółka starają się zarządzać – prowadzi równolegle kilka programów badawczych, duże programy motywacyjne oraz kompetentne międzynarodowe team’y.
Zamiast podsumowanie, czyli co my na ten temat myślimy
Na podstawie informacji i analiz przekazanych powyżej oceniamy, że wskaźnik zysku/ryzyka w odniesieniu do Pure Biologics, spółki o obecnej kapitalizacji ok. 200 mln zł jest na poziomie co najmniej 3-5, w perspektywie 2-3 lat. Dlaczego? – poszczególne projekty będą wchodzić do badań przedklinicznych i przesuwać się w nich do kolejnych faz. Może się też pojawić jakakolwiek umowa, z pieniędzmi lub bez. To wszystko może spowodować wzrost wartości, ponieważ rynek, naszym zdaniem, wycenia w niewielkim stopniu te zdarzenia. W drugą stronę wykresu – cena ostatnie emisji, wziętej w powyżej 80% przez instytucje to 90 zł. Obserwujemy na obecnych poziomach pakiety akcji po kilkaset tys. zł kupowane przez kogoś z rynku. To wszystko daje prawdopodobieństwo obrony kursu i powolnej akumulacji, w szczególności wobec dużej ilości posiadanej przez instytucje gotówki. Warto wspomnieć, o rzeczywistym free float – minimalnym wobec struktury akcjonariatu od początku opieranej prawie wyłącznie na instytucjach (w większości schowanych pod progiem raportowania tj. 5%).
Na koniec – na rynku są dwa rodzaje spółek biotechnologicznych i med-techowych – małe spółki z kapitalizacją 100-300 mln zł, zazwyczaj zbudowane na oczekiwaniach, postępie prac, wypowiedzi czy obietnic spółek. Trzeba sobie jasno powiedzieć, że wiele z nich nigdy nie zrealizuje zapowiedzianych projektów. Na rynku są także duże spółki z tej dziedziny, które już coś pokazały. Te mają kapitalizację od 0,8 do 2 mld zł. Jak rozpoznać te pierwsze z potencjałem, które jeszcze nie są, a mogą przeskoczyć do grona tych drugich. Jedyna droga to dokładna analiza, cierpliwość i zimna ocena oraz oczywiste monitorowanie bieżące z dobrą znajomością realiów biotechu.
|
|
Temat:
PURE
Ukazała się informacja o zakończeniu pierwszego pilotażowego badania przedklinicznego w ramach projektu PB001 Multibody. Głównym celem badania na myszach z wszczepionym ludzkim układem odpornościowym była ocena bezpieczeństwa, a drugorzędowym celem było monitorowanie symptomów odpowiedzi immunologicznej skierowanej przeciwko guzom nowotworowym. Podczas badania nie zaobserwowano żadnych objawów ostrej toksyczności lub poważnych zmian histopatologicznych. Wykazano, że cząstka badana aktywuje układ odpornościowy, a spółka będzie kontynuował badania przedkliniczne w szerszym panelu. infostrefa.com/infostrefa/pl/w...Znakomita, długo wyczekiwana informacja. Gratulacje dla całego zespołu. Skończenie z sukcesem pierwszej fazy badań przedklinicznych dla pierwszego projektu spółki to rzeczywiście „krok milowy”. Pamiętajmy, że to nie tylko otwiera możliwość rozmów z Big Pharmą, ale co wielokrotnie podkreślała sama spółka przeciera szlaki do kolejnych projektów, które będą systematycznie wchodziły do badań przedklinicznych. Rynek prawie od roku porusza się bocznym trendzie i mało kto potrafił wytrzymać ten czas będąc na akcjach spółki. Rzeczywiste free float jest minimalne wobec struktury akcjonariatu od początku opieranej prawie wyłącznie na instytucjach. Dla mnie Pure Biologics, poza aspektem inwestycyjnym – jej projekty, ich struktura, prowadzenie i rozwój firmy, zachowanie kursu (w tym skrajne emocje akcjonariatu) jest niezwykłym casem edukacyjnym. Należy wyciągać wnioski i uczyć się, aby można to wykorzystać do kolejnych inwestycji niezwykle ciekawego polskiego biotechu.
|
|
Temat:
PURE
Opublikowany został raport analityczny BOŚ, autorem tak jak poprzednio jest Sylwia Jaśkiewicz. Dla klientów banku raport będzie dostępy D+3, dla inny użytkowników D+7. Jaka jest wycena tego oczywiście nie wiem (będziemy wiedzieć najwcześniej 20.05), ale warto przypomnieć, że w listopadzie 2020r przy ostatniej emisji akcji i przejściu spółki na GWP już został wykonana przez tę instytucję raport. Zgodnie z nim wycena spółki po emisji mieściła się w przedziale 272 – 510 mln zł. Była to oczywiście wycena ustalona na podstawie stopnia zaawansowania projektów (listopad 2020r). A od tamtej pory nastąpił rozwój projektów a jeden z nich jest w badaniach przedklinicznych (kończy pierwszą paczkę tych badań), drugi ma podpisaną umowę na takie badania.
Wobec powyższego, jedyny logiczny wniosek- wycena może być tylko wyższa.
|
|
Temat:
PURE
Porównanie spółek biotechnologicznych Captor Therapeutics oraz Pure Biologics.
Poniższą analizę napisałem wraz ze swoim synem Michałem. Przyjemnego czytania :)
Captor Therapeutics zmierza zadebiutować na rynku głównym, co połączone jest z emisją akcji. Spółka zajmuje się rozwojem leków w nowatorskiej technologii TPD. Jest o niej ostatnio bardzo głośno w różnych mediach skierowanych do inwestorów. My z kolei, widzimy w niej bardzo wiele podobieństw do spółki obserwowanej przez nas od dawna – Pure Biologics. Z tego względu pokusiliśmy się o małą analizę porównawczą.
1) Technologie, w jakich spółki rozwijają swoje projekty
Captor Therapeutics - Targeted Protein Degradation (celowana degradacja białek) – technologia, która wykorzystuje naturalne procesy usuwania patogennych białek. Technologia TPD przełamuje wiele z dotychczasowych ograniczeń leków, usuwając białka oporne na działanie dostępnych terapeutyków, białka, dla których nie ma możliwości opracowania klasycznych inhibitorów oraz wykorzystując potencjalną przewagę efektów farmakologicznych degraderów nad inhibitorami.
Pure Biologics - immunonkologia – terapie mające skierować układ odpornościowy do walki z nowotworem oraz terapie pozaustrojowe wykorzysujące aptamery (sztucznie wyprodukowane krótkie fragmenty, zbudowane z tego samego materiału, co DNA). Imunoonkologia jest atrakcyjna ze względu na większe bezpieczeństwo dla pacjenta (minimalizowanie skutków ubocznych w odniesieniu do leków konwencjonalnych) oraz wykorzystanie naturalnych środków obronnych organizmu.
Gdybyśmy mieli bardzo ogólnie uporządkować terapie lekowe w walce z nowotworami od najstarszych do najnowszych wyglądałoby to następująco: klasyczna terapia, terapia celowana, immunoterapia, celowana degradacja białek. Technologia rozwijana w spółce Captor Therapeutics jest najbardziej innowacyjna, jednak rozwijana na szerszą skalę de facto dopiero od 2015 r. Leki biologiczne zaliczane też do nowatorskich technologii, są lepiej poznane i w praktyce na szerszą skalę już wykorzystywane. Obydwie spółki umiejscowione są w najbardziej atrakcyjnej części rynku biotechnologicznego: pracują nad stworzeniem leków „first in class” , czyli leków, które wykorzystują nowy i unikalny mechanizm działania.
2) Laboratoria oraz pracownicy
Captor Therapeutics – spółka wynajmuje na terenie Wrocławskiego Parku Technologicznego na wyłączność ok. 1100 m2 powierzchni laboratoryjnej. Laboratorium wyposażone jest w najnowocześniejsze sprzęty, w tym w szczególności: chromatografy do oczyszczania białek np. ligaz E3, sprzęt do pomiarów spektroskopowych np. umożliwiający śledzenie ubikwitynacji i degradacji białek, sprzęt do badań z zakresu biologii strukturalnej i modelowania oraz 18 dygestoriów chemicznych na powierzchni około 400 m2.
Spółka zatrudnia 85 pracowników, (co obejmuje również jedną osobę zatrudnioną w Spółce Zależnej) – 37 z nich posiada stopień naukowy doktora
Pure Biologics – podobnie jw. spółka dysponuje nowoczesnym i dobrze wyposażonym zapleczem laboratoryjno-biurowym o powierzchni ok. 1000 m2, zlokalizowanym we Wrocławskim Parku Technologicznym, w którym zatrudnia 80 pracowników naukowych, w blisko 40% ze stopniem doktora. Łącznie 86 specjalistów obsługuje bezpośrednio segment naukowo badawczy, a w sumie zatrudnionych jest 96 osób w oparciu o umowę o pracę.
Ja zapewniają przedstawiciele obu spółek, ich kompetencje pozwalają realizować wszystkie projekty rozwoju leków (oraz dodatkowo w przypadku Pure Biologics terapeutycznych wyrobów medycznych) od fazy wyboru celu molekularnego do fazy testów in vitro włącznie - w całości w oparciu o własne zasoby naukowe i technologiczne. Pozwala to na całkowitą niezależność od licencjonowania kandydatów na leki od innych podmiotów czy uczelni oraz usługowych firm zewnętrznych, możliwość kontroli i pełną poufność prowadzonych badań w ich początkowym, najbardziej wrażliwym momencie.
3) Własne platformy
Captor Therapeutics – spółka posiada 3 projekty platformowe (projekty P1, P2, P3), (z czego 2 są zakończone). Spółka używa platform do wytwarzania i testowania związków chemicznych w projektach dotyczących rozwoju kandydatów na leki.
Pure Biologics - spółka posiada własne platformy technologiczne do generowania cząstek do programów badawczych PureSelect2 (platforma do generowania białek i przeciwciał) oraz PureApta (platforma do generowania tzw. aptamerów, czyli sztucznie wygenerowanych łańcuchów DNA lub RNA przypominających przeciwciała).
Z praktycznego punktu widzenia inwestora, pomijając możliwość wykonywania dość unikalnych zleceń kontraktowych na własnych platformach (oraz dodatkowo w przypadku Captor Therapeutics, czyli technologii TPD zawierania umów parteringowych do wspólnego prowadzenia prac badawczych) , wynika jedna o wiele ważniejsza sprawa – spółka realizując programy badawcze zaczyna zawsze od generowania cząstek : chemicznych (jak w przypadku Captora) lub przeciwciał i aptamerów (jak w przypadku Pure) wykorzystują własną platformę. Jest to o wiele tańsze, prostsze i wielokrotnie lepsze rozwiązania od tych laboratoriów, których takich platform nie mają. Po pierwsze inne laboratoria muszą taką cząstkę zamówić, – co zajmuje czas i kosztuje, po drugie, jeśli okaże w trakcie badań, że zamówione cząstki nie posiadają pożądanych właściwości trzeba się z powrotem cofnąć i zamówić kolejne cząsteczki badawcze. To wszystko trwa i kosztuje, w analizowanych spółkach nie ma tego rodzaju problemu, bo platformy są ich własnością i to jest wielka wartość dodana spółek.
4) Realizowane projekty
Captor Therapeutics - Spółka realizuje obecnie 5 projektów badawczo-rozwojowych w zakresie odkrycia i opracowania leków na choroby autoimmunologiczne i onkologiczne. CT1 (terapia raka wątrobowokomórkowego), CT2 (terapia chorób autoimmunologicznych i nowotworów układu krwionośnego), CT3 (indukcja apoptozy przy użyciu małocząsteczkowych związków chemicznych, jako interwencja terapeutyczna w schorzeniach nowotworowych), CT4 (opracowanie i rozwój pierwszego w klasie kandydata na lek, małocząsteczkowego degradera, w terapii raka jelita grubego), CT5 (zastosowanie technologii celowanej degradacji białek w terapii łuszczycy i reumatoidalnego zapalenia stawów)
Pure Biologics - Spółka w chwili obecnej posiada 3 projekty lekowe oparte na przeciwciałach: PB001 Multibody (rak jelita grubego i odbytu), PB003 PureActivator (niedrobnokomórkowy rak płuc), PB004 PureBike (potrójnie negatywny rak piersi) oraz 3 projekty (w tym dwa terapeutyczne) oparte na aptamerach : PB002 AptaPheresis, PB005 Apta-MG, PB006 Apta-MLN. Dodatkowo spółka prowadzi dwa konsorcjalne projekty naukowo-technologiczne PB007 (MARA) z partnerami ze środowisk akademickich z czterech krajów oraz PB008 (MAGGBRIS) z partnerami z pięciu krajów europejskich.
5) Jak są rozwijane są poszczególne cząsteczki, na jakim są etapie, – czyli kiedy możemy dojść do komercjalizacji ?
Chcielibyśmy w tym miejscu podkreślić bardzo ważny (a raczej prawdopodobnie najważniejszy) cenotwórczy aspekt dla obu spółek, przyjęty jako konsensus wśród analityków. To rozwijane leki (oraz terapie aptamerowe dodatkowo w przypadku Pure Biologics) są główną wartością spółek i od stopnia ich rozwoju (a w konsekwencji możliwości komercjalizacji) w rzeczywistości zależy ich kapitalizacja. Ten akapit, to naszym zdaniem jedna z najważniejszych podpowiedzi inwestorskich w tej analizie.
Captor Therapeutics – spółka szacuje, kiedy jej projekty znajdą się w fazie I badań klinicznych: w 2023 r projekty CT1, CT2, CT3, pomiędzy 2023 r a 2025 r projekty CT4, CT5). Projekty CT1, CT2, CT3, CT4 są na etapie optymalizacji związku wiodącego, CT5 znajduje się obecnie na etapie ekspansji chemotypów do uzyskania związku wiodącego.
Niestety, opis w prospekcie w zakresie czasu oraz szczegółów rozwojów poszczególnych etapów projektów jest bardziej niż skromny. Należy mieć tylko nadzieję, że w kolejnych raportach kwartalnych zostanie to zmienione i szczegółowe opisy etapów rozwoju cząstek będą na bieżąco określane, ponieważ jest to jedyny element możliwej weryfikacji postępu prac przez inwestora.
Pure Biologics – Pierwszym projektem jest MultiBody PB001, który wszedł do badań przedklinicznych w grudniu 2020r. W kwietniu br, prawdopodobnie, zakończy swoją pierwszą „paczkę badań” przedklinicznych, która powinna wstępnie potwierdzić poprawność przyjętych założeń i otworzyć drogę do następnego etapu badań. Kolejny projekt PB002 AptaPheresis - w marcu br spółka poinformowała w komunikacie o podpisaniu umowy na badania przedkliniczne w ramach projektu, rozpoczną się one w III kw br. W drugim projekcie lekowym PB003, w tym roku, zostaną przeprowadzone testy aktywności in vitro na liniach nowotworowych i komórkach ludzkiej krwi oraz zaplanowano wstępne badanie toksykologiczne i walidacji hipotezy mechanizmu działania w modelu mysim lub modelu zarodków kurzych. W przypadku PB004 w roku bieżącym planowane jest potwierdzenia skuteczności wytypowanych cząsteczek pod względem indukowania odpowiedzi cytotoksycznej wobec komórek nowotworowych, a w projekcie terapeutycznym (PB005) zakończenie i wybór finalnych cząsteczek wiodących oraz zaplanowanie i przygotowanie do badania przedklinicznego w modelu zwierzęcym. W planach spółki jest zakończenie badań przedklinicznych projektów do końca 2023 r.
6) Strategia biznesowa
Captor Therapeutics – Spółka zakłada rozwój projektów w dwóch modelach biznesowych:
a) Głowna- doprowadzenie projekty do etapu badań przedklinicznych lub początkowej części I fazy badań klinicznych, a następnie udzielenie licencji dużemu podmiotowi (partnering) w zamian za płatność up-front, milestones i tantiemy
b) Dodatkowa- współpraca w oparciu o cele partnerów z wykorzystaniem własnych platform. Jest to bardzo często stosowany model w przypadku spółek działających w obszarze technologii TPD (Target Protein Degradation)
Pure Biologics – Zakłada identyczny model biznesowy jak Captor Therapeutics w pierwszym wariancie (strategia główna).
Należy zaznaczyć, że ew. komercjalizacja w obszarach (główny model biznesowy), w których poruszają się spółki następuje zazwyczaj wiele lat wcześniej niż w lekach konwencjonalnych (te ostatnie zazwyczaj podpisują umowy parteringowe w późniejszych fazach klinicznych), co oczywiście jest o wiele atrakcyjniejsze zarówno do spółki jak i dla inwestorów.
7) Transakcje referencyjne
Przedstawiamy zakres realizowanych transakcji referencyjnych. Trzeba zwrócić uwagę na fakt, iż bardzo trudno jest wyznaczyć jakąkolwiek przeciętną wartość tego typu umowy, ponieważ ich rozrzut jest ogromny. Wartość samej transakcji i jej szczegółowe warunki zależą od bardzo wielu czynników: udziału w kosztach, stopnia rozwoju cząsteczki lub technologii, ryzyka niepowodzenia, potencjału sprzedażowego itp. Jednak schemat jest w każdym przypadku bardzo zbliżony. Większość tego typu umów składa się ze stosunkowo niewielkiej płatności wstępnej (up-front), serii płatności wypłacanych za realizację określonych celów (milestones) oraz tantiem od sprzedaży potencjalnego leku.
Captor Therapeutics: Na prezentacji dla inwestorów możemy znaleźć kilkanaście transakcji referencyjnych. Niestety, spółka nie podaje szczegółowych wartości ich poszczególnych etapów, a jedynie całkowite wartości w biodolarach. Wahają się one w przedziale 405 mln – 2,5 mld USD. Z innych źródeł wiadomo, że część z nich nie była realizowana w najbardziej typowym modelu dla spółek biotechnologicznych, ale w „drugim wariancie” Captora, czyli współpracy w oparciu o cele partnerów z wykorzystaniem własnych platform spółki. Możliwe, że wytłumaczeniem tego faktu jest nowość technologii.
Pure Biologics: Spółka na swoich prezentacjach wielokrotnie pokazywała wybrane transakcje referencyjne. Jak zapewnia, transakcje te były precyzyjnie dobrane pod względem podobieństwa i dotyczą bardzo podobnych obszarów terapeutycznych (immunoonkologia) oraz cząstek aktywnych leku jak rozwijane przez nich (np.: przeciwciała bispecyficzne jako cząstki aktywne leku w kategorii First- in –class). Podane wartości to od 15 mln euro (transakcja na początku fazy przedklinicznej) do 120 mln USD ( transakcja przed pierwszą fazą kliniczną) jako Up-front + 0,6 do 1,7 mld Milestones + Royalties /jedną cząsteczkę.
8) Pieniądze na badania
Captor Therapeutics – środki pozyskane z obecnej emisji przeznaczone będą do realizacji celów strategicznych spółki w perspektywie do końca 2022 r., związanych przede wszystkim z działalnością badawczo-rozwojową, w tym w szczególności dotyczącą obecnie realizowanych projektów, jak i przyszłych projektów, które spółka zamierza zrealizować.
Pure Biologics - Wszystkie obecne projekty komercyjne będą realizowane do końca 2023r. Katalog projektów na dzisiaj jest zamknięty. Ostatnia emisja spółki była w grudniu 2020r, w których spółka pozyskała 54 mln zł.
Spółka szacuje łączne nakłady potrzebne na zrealizowanie kluczowych projektów w latach 2020-2023 na ok. 130,4 mln zł, z czego 47,8 mln zł planuje sfinansować środkami pozyskanymi z ostatniej emisji, a pozostałą część środkami pochodzącymi z kolejnych transz dotacji oraz środkami własnymi pozyskanymi m.in. z bieżącej działalności spółki.
9) Programy motywacyjne
Obydwie spółki traktują pracowników jako swój największy kapitał i trudno się z tym nie zgodzić, bo to oni są decydującym ogniwem sukcesu lub jego braku. Ludzi i to jak najlepszych, trzeba przyciągać lub jeśli już są zatrzymać i zmotywować. Wtedy spółki będą miały prawdopodobieństwo uzyskania jak najlepszych wyników prac i ich skomercjalizowania a kapitalizacja rynkowa jest oczywiście wyłącznie pochodną powyższych
Na podstawie obydwóch programów motywacyjnych osoby uprawnione będą miały prawo do nabycia istniejących lub nowo wyemitowanych akcji spółki. Cena jednostkowa sprzedaży takiej akcji wynosi 0,10 PLN.
Captor Therapeutics - na datę prospektu zawarto umowy udziału w programie motywacyjnym z 70 pracownikami (w tym byłymi pracownikami) na łączną liczbę 147.673 akcji oraz z niektórymi członkami Rady Nadzorczej, na łączną liczbę 49.772 akcji. Zarząd spółki, po uzyskaniu zgody rady nadzorczej, jest uprawniony do uzupełniania listy osób uprawnionych do uczestnictwa w programie o nowo zatrudnione osoby i zawarcia umów z tymi osobami – do czasu wyczerpania łącznej puli 237.244 akcji zwykłych spółki. Akcje te zostaną wyemitowane.
W celu uczestnictwa w programie motywacyjnym, pracownicy spółki będą zawierali umowy, na podstawie których nabycie akcji odbywać się będzie w czterech równych transzach, przypadających na pierwszą, drugą, trzecia i czwartą rocznicę zawarcia umowy udziału w programie motywacyjnym. Warunkiem nabycia prawa do kolejnych transz jest pozostawanie przez pracownika w zatrudnieniu w dacie kolejnych rocznic podpisania umowy udziału w programie motywacyjnym. Pracownicy spółki w umowach dotyczących udziału w programie motywacyjnym zobowiązują się nie zbywać nabytych akcji przez okres roku od daty nabycia danej transzy akcji.
Pure Biologics – elementem programu motywacyjnego jest 241 000 akcji własnych oddanych przez akcjonariuszy założycieli, którzy postanowili przeznaczyć część należących do nich akcji, nie obciążając tym samym pozostałych akcjonariuszy czyli nie rozwadniając kapitału. Dotyczyło to aż 14,6% kapitalizacji spółki (przed ostatnią emisją) i stanowiły one ok. 26% akcji posiadanych przez akcjonariuszy założycieli. Program motywacyjny trwający od stycznia 2020r będzie realizowany do stycznia 2022r, na akcje są podpisane obowiązujące w tym czasie umowy lock-up. Programem motywacyjnym objętych jest 81 pracowników spółki.
10) Ryzyka
W obydwu spółkach ten element jest wspólny. Najważniejsze z ryzyk naszym zdaniem to:
– nie przejście poszczególnych programów badawczych do kolejnych etapów
- brak finansowania
- odejście kluczowych osób
- trudności w pozyskaniu partnera w dalszym rozwijaniu cząstek
Ale trzeba też pamiętać, że powyższymi ryzykami spółki starają się zarządzać– spółki posiadają równolegle kilka programów badawczych, duże programy motywacyjne oraz kompetentne międzynarodowe teamy.
11) Kapitalizacja spółek
Captor Therapeutics - Przedmiotem obecnej oferty spółki jest 1069500 akcji zwykłych z ceną 172 zł/szt. Spółka oczekuje, że wpływy netto z emisji wyniosą 149,9 mln PLN. Wobec powyższego kapitalizacja spółki po udanej emisji powinna wynosić 710 mln zł (a uwzględniając wszystkie akcje z programu motywacyjnego 750 mln zł).
Pure Biologics - obecna kapitalizacja rynkowa spółki wynosi 270 mln zł.
Warto przypomnieć, że w listopadzie 2020r przy ostatniej emisji akcji i przejściu spółki na GWP został wykonana przez BM Boś raport analityczny. Zgodnie z nim wycena spółki po emisji mieściła się w przedziale 272 – 510 mln zł. Jest to oczywiście wycena ustalona na podstawie stopnia zaawansowania projektów (listopad 2020r) i wraz z postępami prac będzie się zmieniać. Należy przypomnieć, iż od tamtej pory nastąpił rozwój projektów a jeden z nich jest w badaniach przedklinicznych, drugi ma podpisaną umowę na takie badania.
W tym miejscu warto przypomnieć o generalnej zasadzie wzrostu cen akcji w dniach ogłoszenia transakcji: Według analiz HBM Partners, średni wzrost cen akcji w dniu ogłoszenia transakcji w 2019 wyniósł prawie 100%, co ciekawe stwierdzono również, że w latach 2015-2019 wzrost był wyższy w przypadku mniejszych, a mniejszy w przypadku większych transakcji. Również na naszym polskim podwórku ostatnio tego typu transakcja miała miejsce - OncoArendi Therapeutics podpisało umowę z belgijskim Galapagos.
|
|
|
Świetna robota Przemku. Brawo.
|
|
Temat:
PURE
Umowa na badanie przedkliniczne AptaPheresis oraz kilka słów o pozostałych projektach PureBiologics
Pure Biologics poinformował w komunikacie o podpisaniu umowy na badania przedkliniczne w ramach projektu PB002 – AptaPheresis (link do komunikatu). Usługa zostanie wykonana przez instytut badawczym Sieci Badawczej Łukasiewicz – Instytut Przemysłu Organicznego (oddział w Pszczynie). Należy wspomnieć, że to już drugi projekt spółki na etapie przedklniki, pierwszym jest MultiBody PB001 który wszedł do badan przedklinicznych w grudniu 2020r.
Celem samego projektu PB002 jest opracowanie wyrobu medycznego do stosowania w terapii u osób zmagających się z Neromyelitis Optica (Zespół Devica). Produkt będzie miał postać kolumny, stanowiącej adsorber (filtr) działający w oparciu o aptamery, który usunie wybrane czynniki chorobotwórcze z osocza pacjenta, podczas gdy inne składniki krwi zostaną zawrócone do krążenia.
W pierwszej części badań przedklinicznych, zostaną przeprowadzone testy toksykologiczne oraz toksykokinetyczne patogennego przeciwciała anty-AQP4, żeby określić podstawowe warunki przeprowadzenia właściwego eksperymentu wychwytywania tego przeciwciała przez filtr zawierający aptamery (etap, na który została podpisana umowa).
Po tym etapie spółka planuje, że we właściwych badaniach przedklinicznych, modelowe rekombinowane przeciwciała anty-AQP4 (cel molekularny) zostaną podane królikom by zasymulować warunki choroby NMO (obecność tych przeciwciał w krwi), a następnie w wyniku procedury celowanej aferezy przy użyciu specyficznego filtra, sprawdzona zostanie skuteczność usunięcia patogennych przeciwciał z krwiobiegu zwierzęcia.
Co z pozostałymi projektami?
Trzeba być świadomym, że ten rok będzie swoistym „sprawdzam” dla projektów spółki. Zgodnie z wcześniejszymi zapowiedziami kolejny projekt lekowy (PureActivator PB003) powinien wejść do badań przedklinicznych pół roku po pierwszym projekcie lekowym (Multibody PB001), czyli na przełomie II i III kw br, a po kolejnym pół roku PureBike PB004. Jak sądzę podobnie będzie to wyglądało w przypadku projektu aptamerowego PB005, który wejdzie do badań przedklinicznych jakiś czas po pierwszym. Należy też pamiętać, że Multibody PB001 powinien w kwietniu, prawdopodobnie, zakończyć swoją pierwszą „paczkę badań” przedklinicznych. Spółka powinna wtedy opublikować raport nt. temat.
Czy będzie tak, jak piszę powyżej, ja tego oczywiście nie wiem, jednak staram się śledzić poczynania spółki i jej wcześniejsze zapowiedzi. Dlatego mogę tylko powtórzyć, iż rok 2021 r będzie oczywistym sprawdzianem dla spółki i jej wcześniejszych zapowiedzi.
|
|
Bioceltix – inwestorska analiza weterynaryjnej spółki biotechnologicznejSpółka Bioceltix S.A. jest w trakcie procesu IPO, szykuje się do wejścia na rynek Newconnect, a pierwsze notowania akcji nastąpią w II-III kwartale bieżącego roku. Ze względu na powyższe przedstawiam całościową analizę tej spółki biotechnologicznej. Czym zajmuję się spółka?Bioceltix pracuje nad wprowadzeniem do obrotu leków biologicznych – produktów leczniczych dla zwierząt towarzyszących (psów, koni), zawierających mezenchymalne komórki macierzyste, jako składnik aktywny w oparciu o własną wytwórnię działającą w farmaceutycznym standardzie jakości cGMP (ang. Current Good Manufacturing Practice). Opracowane przez spółkę produkty będą stosowane w leczeniu najczęściej występujących chorób o podłożu autoimmunologicznym i zapalnym, takich jak zmiany zwyrodnieniowe stawów u psów, zapalenia stawów u koni czy też atopowe zapalenie skóry u psów. Dlaczego właśnie weterynaria i leki biologiczne?Rynek weterynaryjny często porównywany jest przez inwestorów do rynku leków dla ludzi. Jest oczywiste, że jest to rynek mniejszy, lecz mało kto zdaje sobie sprawę, iż w samej tylko UE jest około 70 mln psów. Zgodnie z danymi literaturowymi, co szósty pies choruje na atopowe zapalenie skóry, a co piąty ma zapalenie stawów. Zwierzęta żyją dłużej, a z roku na rok coraz więcej z nich objęte jest opieką weterynaryjną, ponieważ ludzie traktują je jako członków rodziny. Wszystkie największe firmy weterynaryjne dążą do tego aby mieć w swoim portfolio nowej generacji leki biologiczne, działające przyczynowo w odróżnieniu od leków chemicznych, które są tak naprawdę lekami objawowymi. Za większą skutecznością leków biologicznych idzie oczywiście większy potencjał sprzedaży, jak i uzyskiwanych cen. Mówiąc krótko, rynek biologicznych leków weterynaryjnych jest obecnie w fazie rozwoju na wielomiliardowym rynku leków dla zwierząt. Spółka mówi wprost, że widzi niszę, chce i potrafi ją skutecznie wykorzystać Czym właściwie są komórki macierzyste?Należą one do grupy pierwotnych komórek organizmu. Mają one zdolność do namnażania oraz przekształcania się w konkretne, wyspecjalizowane typy komórek potomnych tworzących tkanki. Mezenchymalne komórki macierzyste (MSC) w organizmie ssaków stanowią naturalny rezerwuar służący ciągłej wymianie uszkodzonych i zużytych komórek oraz regulują związane z tym procesy. Jedną z kluczowych właściwości MSC wykorzystywanych w projektowaniu leków jest zdolność do łagodzenia stanów zapalanych i ich redukcji poprzez modulację środowiska zapalnego. Pełna treść analizy growthinvestment.pl/bioceltix-...
|
|
|
Zakładam wątek i rozpoczynam obserwację nowej spółki Bioceltix S.A. Spółka w chwili obecnej nie jest spółką publiczna, debiut na New Connect planowany jest w II kw. 2021r. Na początek chciałbym zamieścić ogólny opis, potencjał oraz ryzyka. Później będę systematycznie publikować szczegółowe analizy.
Bioceltix jest firmą tworzącą leki biologiczne w oparciu o mezenchymalne komórki macierzyste dla zwierząt towarzyszących – psy, koty, konie sportowe. Tego typy leki charakteryzują się między innymi ograniczoną ilością skutków ubocznych oraz dłuższym działaniem. Najbardziej zaawansowany projektem jest BCX-CM-J na zmiany zwyrodnieniowe u psów (schorzenie to posiada ok. 20% populacji), drugi pod względem zaawansowania jest projekt BCX-CM-S na atopowe zapalenie u psów (15% populacji). Spółka prowadzi dodatkowo kilka innych projektów badawczych. Segment leków biologicznych w weterynarii jest bardzo młody i szybko rozwija się, pierwszy taki lek został zarejestrowany w 2017 roku.
Zarząd obecnie rozmawia z partnerami branżowymi, kilka podmiotów już przeprowadziło due diligence. Spółka liczy na umowę z dużym partnerem branżowy, który za wyłączność do sprzedaży przyszłego leku wypłaci milestony, royalties itp. oraz pokryje część kosztów developmentu. Umowa planowana jest po przeprowadzeniu fazy skuteczności (właściwa część badania klinicznego) w 2022r. To etap odpowiadający zakończeniu III fazy badań klinicznych na rynku leków dla ludzi.
W planach zespołu znajduję się przejście pełnej ścieżki rejestracyjnej w Europejskiej Agencji Leków (EMA), w przygotowaniach do tego procesu korzystają z usługi doradczej w tej instytucji.
Bioceltix posiada zaplecze produkcyjne w standardzie farmaceutycznym GMP, czyli takie jak w przypadku leków dla ludzi, uruchomione w październiku 2020. Jest to trzecią firmą na świecie, która uzyskała certyfikacje GMP w weterynarii w terapiach komórkowych. Leki poddawane testom bezpieczeństwa oraz badaniom klinicznym muszą być tworzone w takim samym standardzie jak produkt docelowy, czyli GMP. Na obecnych urządzeniach są w stanie produkować w przyszłości leki, wydajność to kilkadziesiąt tysięcy dawek rocznie.
Materiał niezbędny do produkcji to tzw. odpad biologiczny, który pozostaje po wykonaniu zabiegu na przebadanym zwierzęciu. Następnie jest on dodatkowo sprawdzany, oczyszczany, a komórki namnażane. Zespół opracował cały proces tak, że jest w pełni skalowalny, pozwala na masową produkcję, co jest ogromną zaletą opracowanej metody.
Harmonogram dla pierwszego leku
2021 – Faza bezpieczeństwa TAS
2022 – Badanie kliniczne
2023 – Złożenie wniosku do EMA
2024 – Rejestracja produktu
Po uzyskaniu zgody od Głównego Inspektora Farmaceutycznego w styczniu 2021r. rozpoczęto fazę bezpieczeństwa w ramach badań in vivo w zakresie badania tumorogenności. Kolejnym etapem będzie badanie bezpieczeństwa na gatunku docelowym (psy) w ramach badania TAS (Target Animal Safety). Badanie zostanie przeprowadzone w kontrolowanych warunkach zgodnie z wymaganiami Dobrej Praktyki Laboratoryjnej (GLP – Good Laboratory Practice) w certyfikowanym ośrodku CRO (Contract Research Organization). Zakończenie fazy bezpieczeństwa pozwoli wejść w decydującą fazę rozwoju związaną z terenowym badaniem klinicznym prowadzonym już na pacjentach klinicznych.
Potencjał oraz główne atuty spółki
Tworzenie leków biologicznych z zakresu immunologii. To obecnie jedna z najbardziej zyskownych ścieżek, zarówno w medycynie jak i weterynarii, którą zauważyli wszyscy giganci farmaceutyczni.
Doświadczony zespół z dogłębną wiedzą w zakresie naukowym jak i managerskim, wykazujących się bardzo dobrą znajomością branży
Aktywnie kontrolowanie ryzyka między innymi korzystanie z doradztwa w Europejskiej Agencji Leków
Posiadanie, jako trzecia firma na świecie certyfikacji GMP w weterynarii w terapiach komórkowych
Aktywne rozmowy z partnerami branżowymi, przeprowadzone due diligance
Planowane podpisanie pierwszej umowy z partnerem branżowym w 2022r.
Bardzo ograniczona dostępność zatwierdzonych sposobów leczenia z wykorzystaniem komórek macierzystych
Wady, zagrożenia
Możliwość zakończenia się niepowodzeniem danego projektu/lub projektów, wydłużenie czasu trwania projektów.
Ryzyko konkurencji
Ryzyko utraty kluczowego personelu badawczego
|
|
Temat:
PURE
Jakiś czas temu pisałem już o tym, iż w Bazie Konkurencyjności zostało opublikowane ogłoszenie na „Usługę badawcza polegająca na wyznaczeniu utrzymania się dawki ludzkiego, rekombinowanego, monoklonalnego przeciwciała w krwiobiegu królika”. Dotyczyło ono najbardziej zaawansowanego projektu terapeutycznego PB002 AptaPheresis. Ta usługa badawcza to nic innego jak pierwszy panel badań przedklinicznych PB002 AptaPheresis. Termin składania ofert minął właśnie 15.02. Jeśli przetarg został rozstrzygnięty, mam nadzieję, że za krótki czas powinien się ukazać komunikat o podpisaniu umowy a następnie o rozpoczęciu badań przedklinicznych, na co czeka wielu inwestorów. Jeżeli tak się stanie, to Pure Biologics będzie spółką biotechnologiczną z dwoma projektami na etapie przedklinicznym (jednym lekowym i jednym terapeutycznym) i w oczywisty sposób powinno się to przełożyć na kapitalizację spółki.
Powyższy scenariusz uważam za prawdopodobny. Spółka jest dość sprawna operacyjnie - w projekcie lekowym PB001 MultiBody czas pomiędzy zamknięciem terminu składania ofert (3.11.) a komunikatem o podpisaniu umowy na badania przedkliniczne (19.11.) wynosił 16 dni.
|
|
Temat:
PURE
Kolejny krok w kierunku badań przedklinicznych PB002 AptaPheresis Warto co jakiś czas sprawdzać obserwowane spółki w Bazie Konkurencyjności. Jest to miejsce, w którym wszystkie podmioty korzystające ze środków unijnych są zobowiązane publikować ogłoszenia przetargowe. Tym razem ciekawe ogłoszenie zostało opublikowane przez Pure Biologics. Można w nim przeczytać, że jest to „Usługa badawcza polegająca na wyznaczeniu utrzymania się dawki ludzkiego, rekombinowanego, monoklonalnego przeciwciała w krwiobiegu królika”, poniżej widnieje numer zapytania ofertowego, czyli PB002/01/2021 oraz w samym zapytaniu ofertowym umieszczono tytuł projektu: „Rozwój pierwszego w klasie terapeutycznego wyrobu medycznego do stosowania w leczeniu autoimmunologicznej choroby neurodegeneracyjnej”. Sugeruje to, że mamy do czynienia z najbardziej zaawansowanym projektem terapeutycznym PB002 AptaPheresis. Więcej wyjaśnia lektura raportu za III kw, przy opisie tego projektu możemy przeczytać: W etapie 4 projektu, Spółka zamierza zaangażować Podwykonawców, którzy przeprowadzą szereg niezbędnych badań przedklinicznych (na zwierzętach) w zakresie oceny bezpieczeństwa i skuteczności prototypu biomolekularnego filtra aptamerowego. Warunkiem do przeprowadzenia badań przedklinicznych na modelu zwierzęcym jest wykonanie w pierwszej kolejności testów toksykologicznych oraz toksykokinetycznych modelowego patogennego przeciwciała anty-AQP4, żeby określić podstawowe warunki przeprowadzenia właściwego eksperymentu wychwytywania tego przeciwciała przez filtr zawierający aptamery.Są to dość ciekawe informacje świadczące o tym, że projekt AptaPheresis coraz bardziej zbliża się do badań przedklinicznych. Ogłoszenie w Bazie Konkurencyjności można znaleźć pod następującym linkiem: bazakonkurencyjnosci.funduszee...
|
|
Temat:
SCPFL
Ponieważ przez blisko dwa lata sporo pisałem na temat Scope Fluidics, chciałbym podsumować jaki jest mój pogląd na te spółkę obecnie.
4 grudnia spółka Scope Fluidics wydała bezpośrednio przed sesją komunikat, zaraz po tym odbył się czat inwestorski organizowany przez Camparic. Zacznijmy od formy przekazu komunikatu podanego pół godziny przed sesją i godzinę przed czatem. Zawiera on bardzo wiele szczegółowych zagadnień, których ze względu na ograniczenia czasowe nie można było dokładnie przeanalizować, aby następnie zadać pytania zarządowi. Co więcej, pomimo, iż na czacie pojawiło się kilka szczegółowych, kluczowych pytań dotyczący systemów (chodzi o panel SARS COV-2 i MRSA), nie zostały one, niestety, odczytane i internauci nie uzyskali na nie odpowiedzi. Spółka, która nie komunikowała się z inwestorami od jakiegoś czasu, których systemy są jak mówią „na ostatniej prostej” zdecydowanie powinna znaleźć w moim przekonaniu dodatkową godzinę, aby rozwiać wszelkie wątpliwości, a nie pozostawić wyraźny niedosyt informacyjny. Sam komunikat porusza wiele różnych bieżących aspektów ostatniej działalności min. rozmowy z potencjalnymi inwestorami, ilość podpisanych umów NDA, rozwój systemów, przygotowanie mocy produkcyjnych itp. Zostawiając to wszystko na boku, dla mnie w chwili obecnej liczy się jedynie podstawowy element – problemy w rozwoju technicznym panelu SARS COV-2 i MRSA. Dlatego, że ich całkowite zakończenie (przynajmniej jednego), przejście badań certyfikacyjnych, wreszcie certyfikowane a następnie zarejestrowanie – jest warunkiem kluczowym a zarazem koniecznym jakiejkolwiek przyszłej transakcji. Na dzisiaj wydaje się, że do tego wszystkiego jest niezbędna co najmniej kilkumiesięczna droga, ponieważ terminy kolejny raz zostały przesunięte tym razem na I kw. 2020r. Ze względu na powyższe, czyli wzrost ryzyka na spółce, przekładanie kolejnych terminów i w moim przekonaniu, słabą komunikację ważnych elementów na dzień dzisiejszy wstrzymuję obserwację spółki Scope Fluidics. Jednocześnie, co podkreślam, wzrost ryzyk na spółce nie przekreśla jej potencjału, ponieważ są to zupełnie odrębne rzeczy.
Życzę spółce wszystkiego najlepszego, jak najszybszego skończenia i sprzedaży zarówno pierwszego jak i drugiego projektu, ponieważ im najwięcej spółek będzie sprzedawało swoje innowacyjne projekty tym lepiej dla polskiego rynku kapitałowego.
|
|
Temat:
PURE
Podsumowanie emisji akcji Pure Biologics3 grudnia 2020 Pure Biologics dokonał przydziału 600 000 akcji, cena emisyjny wynosiła 90 zł, więc wpływ do Spółki to 54 mln zł. Emisja została rozdzielona w następujący sposób: 100.000 akcji w Transzy Detalicznej, zostało objęte przez 2 293 inwestorów 500.000 akcji w Transzy Inwestorów Instytucjonalnych, zostało objęte przez 69 inwestorów Redukcja zapisów dla inwestorów indywidulanych wynosiła aż 91,278%. Część akcji została objęta przez osoby związane ze spółką: a) W transzy dla inwestorów indywidulanych Andrzej Kierzkowski – Członek Rady Nadzorczej objął 270 akcji b) W transzy dla inwestorów instytucjonalnych Augebit FIZ (beneficjentem rzeczywistym jest Tadeusz Wesołowski, Wiceprzewodniczący Rady Nadzorczej) objął 26 000 akcji Istotną informacją jest również fakt, że Aviva Investors Poland Towarzystwo Funduszy Inwestycyjnych S.A. zwiększyło swoje zaangażowanie do 7,56% kapitału zakładowego wobec 0,45% przed emisją. Przedstawicieli spółki na ostatnich konferencjach stwierdzili, że chcą aby ta runda emisji akcji była ostatnią, a wpływy z przyszłych komercjalizacji zasilały kolejne rozpoczynane projekty. Pure Biologics oficjalnie przejdzie na rynek główny 14 grudnia. infostrefa.com/infostrefa/pl/w...
|
|
Wiem, że temat nie jest zbyt mocno omawiany przez inwestorów, a przecież wszyscy wiemy, że jest niezwykle ważny i wg. różnych badań odpowiada za co najmniej 50% (lub więcej) naszych wyników. Dlatego w tym miejscu pokuszę o opublikowanie kilku swoich artykułów (podsumowań) z tego zakresu , które stanowią moje przemyślenia z wielu lat przebywania na rynku. Te teksty, już gdzieś się ukazały, wiec jeśli ktoś je czytał, to z góry przepraszam, ale tych , którzy nie mieli okazji, zapraszam do zapoznania się z nimi. Zdaję sobie sprawę z tego, że to zasady/przekonania, do których dążę i nigdy ich prawdopodobnie doskonale nie osiągnę, ale lubię czasami do nich wracać, ponieważ pokazują one drogę, którą jako inwestor powinienem podążać. Moje najważniejsze zasady – psychologia w inwestowaniu cz. IZasady psychologiczne czyli najważniejsze na rynku. Sprowadzają się do tego, iż rób to co możesz najlepiej jak potrafisz z pełnym profesjonalizmem i miej gdzieś pieniądze. Rób to wyłącznie dla dobrze wykonanej pracy, wtedy w konsekwencji ta zapłata przyjdzie do Ciebie. Zawsze tak jest w każdym biznesie i w każdej pracy a w inwestowaniu ma to szczególną wagę.– Jestem zdyscyplinowany, wierzę w siebie i dążę do perfekcjonizmu. Jestem uparty a błędy traktuje jako element do poprawy i bycia coraz lepszym w inwestowaniu. – Postępuję jak profesjonalista pewien własnych transakcji. Absolutnie nie skupiam się na informacjach potęgujących obawy, zamiast tego koncentruję się na informacjach pozwalających dostrzec okazję do osiągnięcia zysku – Potrafię, bez wahania, jak najlepsi inwestorzy otworzyć po pozytywnej analizie pozycję a jeśli przynosi ona straty, przyznać się do tego a czynność ta nie jest dla mnie powodem najlżejszego emocjonalnego dyskomfortu a to oznacza, ze w pełni akceptuję ryzyko. Wiem, że to najważniejsza umiejętność inwestora – Nie boję się na rynku niczego ponieważ jestem świadomy, że lęk generuje 95% błędów. Nie mam w sobie odrobiny lęku bo w pełni akceptuję ryzyko – Działam jak profesjonalny inwestor , który oddziela każdą transakcje od siebie jakby istniały w innych układach planet. Jestem świadomy, że oddziaływanie psychiczne poprzedniej lub poprzednich transakcji na obecną jest znakiem firmowym amatora – Otwieram pozycję i wiem, ze w każdym przypadku wynik jest niepewny ale przewaga w ciągu zagrań leży po mojej stronie. Po prostu nie wiem co się wydarzy, ale mi to absolutnie nie jest potrzebne do skutecznego wykonywania tego zawodu. Wszystko co potrzebuję to przewaga w dobrej technice i fundamentach oraz konsekwencja – Pamiętam jak kiedyś czułem się wspaniale, ze rynek zrobił to co się pod nim spodziewałem i czułem się fatalnie jeśli tego nie zrobił i wiem, że to synonim amatorskiego inwestowania i będę się starał do nigdy do tego nie wracać – Moje działanie to otwarcie pozycji, przy określonej przewadze na rynku. Jeśli rynek idzie w druga stronę i pozycja wypada na SL, to trudno, kiedy idzie w moją stronę to idzie. Nie staram się mieć rację, nie staram się uniknąć pomyłki. Kiedy rynek mów mi, że moja przewaga jest nieskuteczna, albo nadszedł czas na realizację zysku to to robię. Całkowicie akceptuję to co rynek mi oferuje i czekam na kolejna okazję. – Błędy popełniane przeze mnie w inwestowaniu wskazują po prostu na to czego powinienem unikać lub co jeszcze przyswoić aby być jeszcze lepszy w tym co robię, są niczym więcej – Profesjonalne traktuję zawód jako dobre wykonywanie swojej pracy. Wyłącznie dogłębna analiza fundamentalna i techniczna- ale tylko to i nic więcej. Są oczywiście w dłużej perspektywie z tym związane pieniądze za dobra pracę, ale zbyt częste myślenie o tym pozbawia sens profesjonalnego inwestowania i lepiej dać sobie wtedy spokój Link do artykułu z częścią II growthinvestment.pl/moje-najwa...Link do artykułu z częścią III growthinvestment.pl/moje-najwa...
|
|
Temat:
DATAWALK
DataWalk "w pigułce" - krótki opis, ocena potenciału oraz ryzykaDawno mi chodziło po głowie zebranie najważniejszych informacji obserwowanych przeze mnie spółek. Wchodzą w skład tego - krótkie opisy spółki oraz najważniejsze zalety, szanse, atuty oraz wady i zagrożenia dla każdej z nich. Takie najbardziej aktualne informacje o danej spółce „w pigułce”. Będę się się starał, aby dane te były najbardziej aktualne i dlatego w razie potrzeby systematycznie modyfikowane. Krótki opis działalności spółkiDataWalk to high-tech od 2012 roku notowany na rynku NewConnect, a od 2019 na rynku główny. Spółka rozwija platformę analityczną na bazie własnej technologii, która pozwala łączyć duże wolumeny danych w rozproszonych zbiorach. Znajduje ona zastosowanie w sektorze prywatnym i państwowym m.in. do wykrywania wyłudzeń (firmy ubezpieczeniowe), przeciwdziałania praniu brudnych pieniędzy (organy ścigania) czy identyfikacji nadużyć i nieprawidłowości (administracja centralna). DataWalk posiada w 100% zależną spółkę w Stanach Zjednoczonych działającą pod nazwą DataWalk Inc., a w zespole znaleźli się m.in. współtwórcy sukcesu takich firm jak Oracle, 3PAR czy Visual Analitycs. Celem spółki jest budowa pierwszego, globalnego produktu w sektorze enterprise IT. Zalety, szanse, atutyDoświadczony zespół sprzedażowy, który zdobywał kompetencje w firmach bezpośrednio konkurencyjnych do DataWalk, personalnie rozpoznawany w środowisku. Produkt o potwierdzonej przez klientów, jakości. Renomowani klienci – agencje wywiadowcze, agencje ubezpieczeniowe, dystrykty policyjne USA, Amerykańskie Ministerstwo Sprawiedliwości i inni. Rosnący rynek cyberprzestępstw. Spółka działa na dużym i dodatkowo nieefektywnym rynku – ma tylko 2 konkurentów, którzy mają istotne wady (znacznie za wysoka cena lub przestarzały produkt). Giełdowa wycena Palantir (konkurencyjna firma) – 52 mld USD. Wady, zagrożenia Pojawienia się nowego konkurenta na rynku analityki powiązań Działania konkurencji mające na celu zatrzymanie rozwoju spółki Potencjalne emisje akcji i rozwadniane kapitału Ryzyko utraty kluczowego personelu badawczego minimalizowane programem motywacyjnym 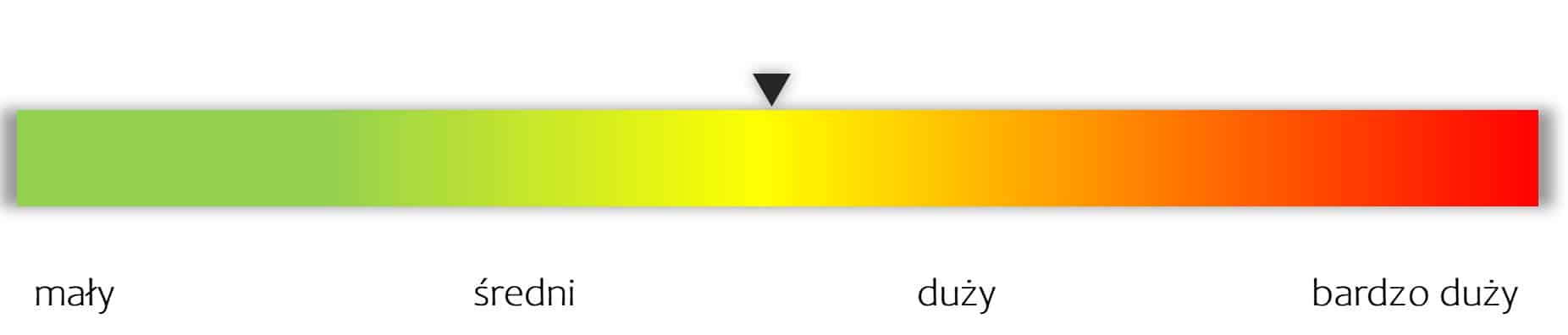
kliknij, aby powiększyćAutorska skumulowana ocena potencjału spółki (w odniesieniu do obecnej kapitalizacji)
kliknij, aby powiększyćAutorska skumulowana ocena ryzyka spółki
Pełen artykuł , z wszystkimi spółkami, dostępny jest pod linkiem growthinvestment.pl/spolki-obs...
|
|
Temat:
PURE
Pure Biologics "w pigułce" - krótki opis, ocena potenciału oraz ryzykaDawno mi chodziło po głowie zebranie najważniejszych informacji obserwowanych przeze mnie spółek. Wchodzą w skład tego - krótkie opisy spółki oraz najważniejsze zalety, szanse, atuty oraz wady i zagrożenia dla każdej z nich. Takie najbardziej aktualne informacje o danej spółce „w pigułce”. Będę się się starał, aby dane te były najbardziej aktualne i dlatego w razie potrzeby systematycznie modyfikowane. Krótki opis działalności spółkiPure Biologics jest firmą biofarmaceutyczną działającą w obszarze leków biologicznych, terapii pozaustrojowych oraz badań kontraktowych. Powstała w 2010 r., a od 2018 r. notowany jest na rynku NewConnect. Spółka prowadzi badania z wykorzystaniem własnych platform technologicznych do selekcji cząstek aktywnych – przeciwciał i aptamerów. Obecnie zespół ok 100 naukowców rozwija następujące, najważniejsze projekty: PB001 MultiBody – rekombinowane bispecyficzne przeciwciało, które może znaleźć zastosowanie w immunoterapii raka jelita grubego PB003 PureActivator – celem projektu jest opracowanie bimodalnego białka fuzyjnego (BBF) we wskazaniu na niedrobnokmórkowego raka płuc PB004 PureBIKE – celem projektu jest opracowanie kandydata na lek, przeciwciała immunoterapeutycznego, do terapii potrójnie ujemnego raka piersi (TNBC) Wszystkie powyższe leki są typu “first-in-class” (pierwsze w swojej klasie – o nowych mechanizmach działania). PB002 AptaPheresis – projekt ma na celu opracowanie innowacyjnego terapeutycznego wyrobu medycznego opartego na aptamerach do stosowania podczas zabiegu selektywnej plazmaferezy u pacjentów z NMO, u których występują zagrażające życiu zaostrzenia objawów chorobowych PB005 AptaMG – projekt ma na celu opracowanie innowacyjnego terapeutycznego wyrobu medycznego opartego na aptamerach do stosowania podczas zabiegu plazmaferezy u pacjentów w trakcie przełomu miastenicznego, tj. zagrażającego życiu zaostrzenia objawów miastenii Zalety, szanse, atutyProfesjonalny zespół naukowców (w tym ok. 40% w stopniu doktora) o wysokich wszechstronnych kompetencjach całego procesu rozwoju projektu od badań koncepcyjnych aż do przygotowania badań przedklinicznych oraz współpraca ze spektrum doradców klinicystów, praktyków. Nowoczesne zaplecze badawcze. Autorskie unikalne w skali światowej platformy do selekcji przeciwciał i aptamerów – PureApta oraz PureSelect. Rozwój trzech leków first in class, leków immuonkologicznych opartych na przeciwciałach, osiągających najwyższe ceny transakcyjne na rynku oraz pozwalających na znacznie wcześniejszą komercjalizację ze względu na potencjał i większe prawdopodobieństwo sukcesu w odniesieniu do leków konwencjonalnych. Równoległe rozwijanie dwóch projektów terapii pozaustrojowej opartych na aptamerach. Projekty te mają o wiele większe prawdopodobieństwo sukcesu niż projekty lekowe , przy niższych cenach transakcyjnych. Na przełomie 2020/2021 pierwszy projekt lekowy PB001 Multibody wchodzi do badań przedklinicznych, w okolicach połowy 2021r do badań przedklinicznych planowany jest projekt lekowy PB003 PureActivator oraz projekt aptamerowy PB002 AptaPheresis. Projekty lekowe planowane są w badaniach przedklinicznych na ok. 1,5 roku, projekt aptamerowy na ok rok. Po ew. pozytywnej pierwszej paczce danych z etapu badań przedklinicznych danego projektu zdobywa on zdolność transakcyjną. Wg. dostępnych danych prawdopodobieństwo sukcesu badań przedklinicznych wynosi 69%, wobec powyższego prawdopodobnym się wydaje, iż przy takiej liczbie projektów przynajmniej jeden lub dwa zdobędzie partering. Finansowanie projektów powyżej 70% przez NCBiR . Wady, zagrożeniaMożliwość zakończenia się niepowodzeniem danego projektu/lub projektów, wydłużenie czasu trwania projektów. Ryzyko ograniczenia dostępności przyznanego a niewypłaconego finansowania ze źródeł publicznych. Ryzyko konkurencji – minimalizowane poprzez systematyczny monitoring rynku rozwijanych leków. Ryzyko utraty kluczowego personelu badawczego – minimalizowane poprzez duży program motywacyjny obejmujący wszystkich pracowników spółki. 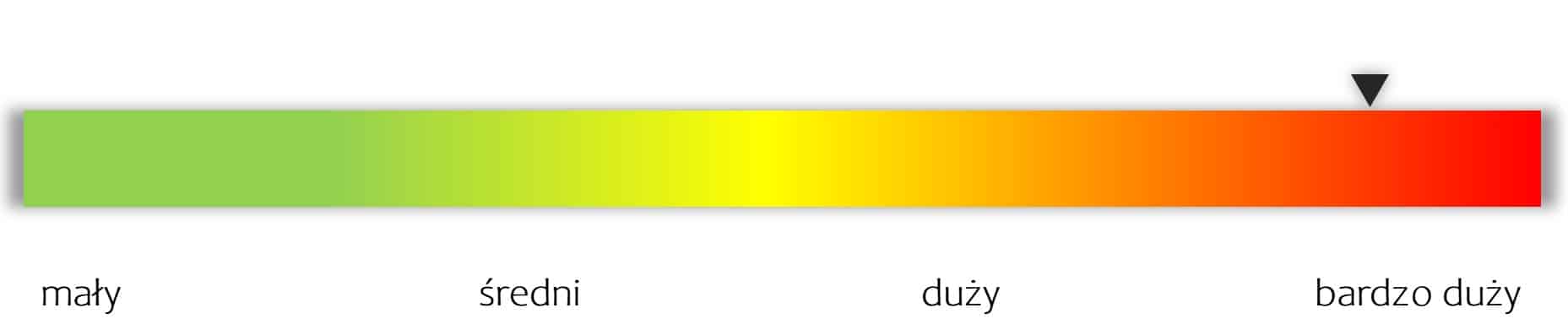
kliknij, aby powiększyćAutorska skumulowana ocena potencjału spółki (w odniesieniu do obecnej kapitalizacji)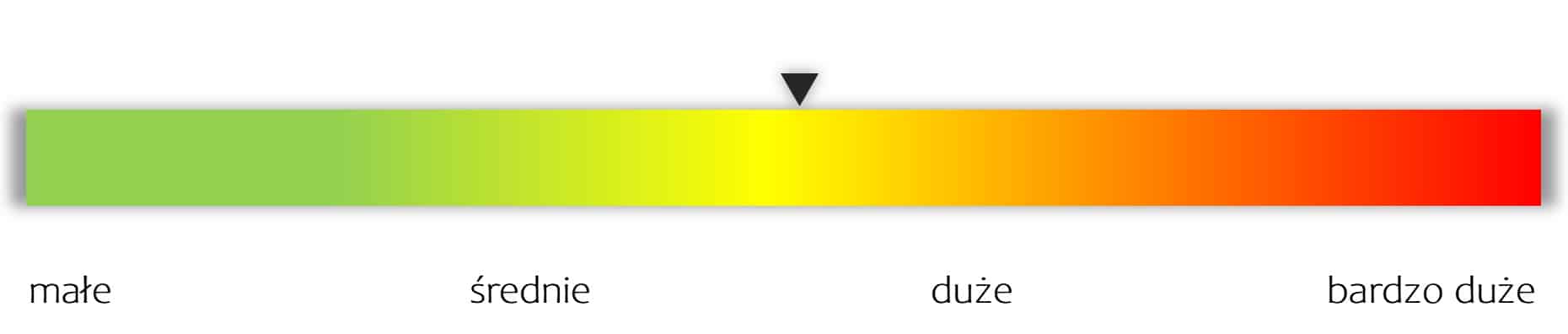
kliknij, aby powiększyćAutorska skumulowana ocena ryzyka spółki
|
|
Temat:
PURE
Pure Biologics – ostatnie wydarzenia, analiza najważniejszych faktówW ostatnim czasie w Pure Biologics bardzo dużo się dzieje. Ta niezwykle ciekawa i moim zdaniem bardzo umiarkowanie wyceniana spółka biotechnologiczna staje się coraz bardziej popularna, co widać chociażby w zmianach rankingów popularności w znanych serwisach inwestorskich. Bardzo mnie to cieszy, ponieważ od blisko dwóch lat spółka jest w moich spółkach obserwowanych, staram się ją regularnie analizować a zdaje się, że jej postrzeganie przez rynek zaczyna się radykalnie zmieniać. Obecnie Pure Biologics przygotowuje się do przejścia na rynek główny połączonego z emisją akcji. W ostatnim czasie zrealizowała kilka konferencji naukowo-edukacyjnych. Niewątpliwie były to bardzo potrzebne działania, ponieważ spółka realizuje swoje projekty biotechnologiczne w zakresie przeciwciał i aptamerów czy materii kompletniej nieznanej przeciętemu inwestorowi. Ponadto ukazał się raport za III kw., ustalono maksymalną cenę emisyjną akcji oraz Boś wydał raport analityczny z wyceną spółki. To bardzo duża różnorodność informacji, dlatego poniżej chciałbym przedstawić klika uwag i elementów, które zasługują na szczególną uwagę inwestora. Poniżej szczegółowo zostały przedstawione następujące zagadnienia
1. E-konferencja przeciwciałowa, skrót, komentarze
2. Raport Boś, na co należy zwrócić uwagę
3. Emisja akcji
4. Raport za III kw. 2020, najważniejsze fragmenty, podsumowanie
Pełna analiza dostępna pod growthinvestment.pl/pure-biolo...
|
|
Temat:
SCPFL
Quo vadis Scope Fluidcis ? – prywatna opinia inwestorskaPierwszy artykuł na temat Scope Fluidics opublikowałem na początku stycznia 2019r, spółka wydawała mi się niezwykle ciekawą, niedostrzeżoną przez rynek firmą. Kompetentni i rozsądni ludzie na pokładzie oraz projekty, globalne systemy diagnostyczne. Wówczas na rynku akcje Scope kosztowały kilkanaście złotych i prawie nikt się tym kompletnie nie interesował… Ale mniejsza o wycenę. Ten doświadczony zespół naukowców na czele z prof. Piotrem Garsteckim, połączenie silnych kompetencji naukowych z pragmatycznym podejściem do biznesu wydawał mi się bardzo ciekawą i perspektywiczną mieszanką. Później na temat spółki pisałem różnego rodzaju informacje, update jak i głębsze analizy. Przyznaję, że oczarował mnie perfekcyjnie wypełniany harmonogram (wielka rzadkość na polskim rynku kapitałowym), znakomite dwa produkty, które mogły poważnie namieszać w światowej diagnostyce medycznej, rada naukowa składająca się ze sław światowej nauki, której członkowie wypowiadali się entuzjastycznie na temat tego, co robiła spółka. Później, jak systemy rozwijane przez spółkę znalazły się wśród siedmiu przełomowych rozwiązań medycznych z całego świata, na dorocznych targach i konferencji organizowanego przez American Association for Clinical Chemistry (AACC) i doszły do półfinału konkurs - oniemiałem. To sukces, którego nie osiągnęła żadna znana mi polska firma. W moich analizach spółki nie bez znaczenia był też fakt, iż doradcą jest Clairfield - z pierwszej dziesiątce doradców finansowych w Europie. Clairfield International opublikował "Clairfield’s Annual Outlook 2019 examines leading themes in business and finance". Wśród kilku rozmówców z całego świata, z różnych dziedzin był wywiad z Szymonem Rutą, członkiem zarządu odpowiedzialnym za kwestie finansowe w Scope Fluidics. Wywiad z nim był opublikowany, jako jedyny w sektorze Healthcare. To było wielkie wyróżnienie, aby wśród setek tematów, które na całym świecie prowadzi tak doświadczony doradca jak Clairfield wybrać właśnie przedstawiciela Scope Fluidics a zarazem potwierdzenie tego, że widzą w Scope Fluidics potencjał i wiążą z nim wielkie nadzieje. W kwietniu br ukazał się raport niezależnej firmy doradczej Yole Developpement “Point-of-Need Testing: Application of Microfluidic Technologies 2020”. Raport dotyczy obecnych możliwości wykrywania wirusa SARS Cov-2. Szczegółowo opisywał on 50 podmiotów na rynku uwzględniając możliwe przez nich wykonywane różnego rodzaju testy obejmujące immunologię, diagnostykę molekularną, chemię kliniczną i inne. Jedyna polską firmą, którą potrafiłem dostrzec, umieszczoną w raporcie był właśnie Scope Fluidics. Bardzo ciekawa była wskazana w raporcie tendencja zmierzająca do zmniejszenia czasu analiz do min. 20 min. jednocześnie powiększając multipleksowość tj. równoległe wykrywanie kilku patogenów a w najbardziej pożądanym obszarze Market-empty zone: upcoming players will try to fill it. były wymienione trzy podmioty w tym PCRone Scope Fluidics. I tak fantastycznie było aż do rozpoczęcia pandemii…. Spółka zbliżała się do rozpoczęcia testów certyfikacyjnych MRSA wraz z PCRone, koniecznych, aby cały system certyfikować jak i później zarejestrować. Niestety, temat nie mógł zostać rozpoczęty. Zaczęły padać koleje terminy harmonogramu. To oczywiste, że przyczyna nie leżała po stronie spółki, po prostu szpitale miały coś innego na głowie niż badania MRSA. Jednak, to czego mi wtedy zaczęło brakować ze strony spółki to czytelnej komunikacji, „nie wiemy, kiedy rozpoczniemy i zakończymy badania certyfikacyjne, ale robimy, co w naszej mocy aby stało się to jak najszybciej, może to będzie pół roku a może dziewięć m-cy wszystko zależy od sytuacji pandemicznej w szpitalach”. Zamiast tego podawano kolejne konkretne terminy, a ja naprawdę nie mam pojęcia skąd spółka mogła wywnioskować, że ten czy inny termin można w otoczeniu pandemii dotrzymać, gdzie dojście do szpitali było do przeprowadzenia badań kluczowe… W międzyczasie spółka rozpoczyna opracowanie panelu SARS-Cov-2. To bardzo dobry krok, odpowiadający dzisiejszemu zapotrzebowaniu rynku. To wszystko trwa, to oczywiste. Trzeba po raz pierwszy zrealizować tzw. odwrotną transkrypcję, czyli przepisanie RNA na DNA, którą później można specyficznie oznaczać. Sprawdzić tzw. biochemię na panelu, aby działała ona stabilnie. A panel jak wszystkie produkty Scope Fluidics jest przygotowywany zgodnie z najwyższymi standardami (w tym zaleceniami WHO) oznaczający aż cztery geny. Jest to zadanie o wiele trudniejsze niż stworzenie wszechobecnych na rynku testów jednogenowych, ale za to o wiele precyzyjnie wykrywający koronowirusa Sars-cov2 a nie inne rodzaje koronowirusów, co jest obecnie niestety powszechne, a mało kto zdaje sobie z tego sprawę. Mijają kolejne miesiące prac, trzeba wykonać testy wewnętrzne, potem testy certyfikacyjne realizowane zgodnie z zasadami amerykańskiego FDA, oraz testy certyfikacji europejskiej. I znowu ścisły termin podany to koniec czwartego kwartału. A zostały dwa miesiące….Hm, może jak się nie uda i trzeba będzie przesunąć to najwyżej będziemy komunikować. Znowu nadzieja…. Tak się nie da. Kolejny temat to finasowanie – trzeba przyznać, że w tym zakresie nie wszystko idzie w tym roku tak jak powinno. Owszem pozyskano 10 mln EUR z Europejskiego Banku Centralnego. Ale nie oszukujmy się, to trudne pieniądze. Nie będę się rozpisywał dlaczego, każdy sam może sobie zweryfikować warunki tego finansowania. Moim zdaniem, można je wziąć wyłącznie w sytuacji „podbramkowej”. Czy dobrze, że spółka je pozyskała? – oczywiście, to pieniądze prestiżowe, doceniane przez rynek nabywców, bo świadczą o wiarygodności spółki. Ale jakoś spółkę trzeba prowadzić i skończyć rozpoczęte projekty, w szczególności PCRone i to za realnie dostępne na rachunku środki. Spółka wystąpiła po środki do NCBiR-u, być może za chwile pokaże się pozytywna informacja i tyle…A miały być różnorodne sposoby finansowania. Znowu ta komunikacja nie taka – zamiast ostatnio, że finansowanie (emisja) „nie powinno być rozumiane jako odstąpienie od określonego wcześniej przez Zarząd zamiaru finansowania z różnych źródeł” – winno być „ szczerze : potrzebujemy, bo musimy zrobić konkretne działania jak.. To budowanie przyszłej pozycji negocjacyjnej, dzięki temu nagroda na końcu tj. cena transakcji będzie większa ”. Tego mi znowu brakowało. Wreszcie koniec listopada to emisja przeznaczona głównie na realizację programy Early Access, program niewątpliwie niezwykle potrzebny stanowiący element procesu budowania przewagi konkurencyjnej. Pojawia się komunikat, że do akcjonariatu wchodzi spółka Cormay. O samej spółce nie będę tutaj pisać, każdy inwestor może dokładnie sprawdzić jej historię. W Scope Fluidics i Cormay głównym akcjonariuszem jest Total Fiz. Spółka Cormay zaoferowała objęcie akcji za łączną maksymalną cenę emisyjną 7 mln zł za pieniądze pożyczone od Orphee SA z siedzibą w Genewie swojej jednostki zależnej. Scope Fluidics publikuje komunikaty, że potrzebuje tej spółki aby „budować bazy potencjalnych klientów i określanie ich potencjalnego zapotrzebowania w odniesieniu do mocy produkcyjnych Curiosity Diagnostics, pozyskiwanie klientów na system PCRone, w tym prowadzenie kompleksowej obsługi procesu sprzedażowego”. Hmm, nie rozumiem… przecież tym miał się zająć przyszły nabywca systemu – potentat światowy, mający doświadczenie, logistkę i rynki zbytu na całym świecie. Czytam o przygotowaniach „sieci dystrybucji systemu PCRone na terenie kraju w celu zwiększenia atrakcyjności biznesowej systemu dla potencjalnego inwestora” i znowu nie rozumiem. Dlaczego akurat na terenie Polski a nie Czech, Austrii czy Szwajcarii – przecież miał być to produkt globalny. Pojawia się informacja, działania te pomogą w programie Early Access (tj. testowanie systemu PCRone przez wielu potencjalnych docelowych użytkowników, zbierania informacji zwrotnej od użytkowników oraz budowania bazy wyników). Ale zaraz… jeśli do tego konieczny zewnętrzny podmiot to nie prościej jest to po prostu zlecić, a nie pozwalać mu wchodzić kapitałowo. Polska chyba nie będzie jedynym krajem, jaki spółka chce umieści w tym programie. Zdaje się , że od lat mówimy o kupującym, dystrybutorze globalnym, wobec tego Early Access ma sens w różnych środowiskach , w tym również w różnych krajach (np.: w renomowanych ośrodkach) czyli obserwowaniu jak się system zachowuje na testowanych różnych typach i podtypach koronawirusa. To byłoby budowanej rzeczywistej przewagi konkurencyjnej dla przyszłego nabywcy, a tak… Spółka Cormay pisze w komunikacie o „podjęciu wstępnych aktywności zmierzających do wejścia na rynek diagnostyki medycznej opartej na biologii molekularnej, którego potencjał rozwoju został potwierdzony podczas trwającej pandemii COVID-19”. I znowu nie potrafię znaleźć w tym sensu- przecież produkt PCRone zostanie sprzedany – więc po co ta spółka chce budować sieć dystrybucji – czy potem zabroni przyszłemu nabywcy globalnemu dystrybucji na terenie Polski i trzeba będzie zrobić wyjątek w umowie – możecie kupić system na cały świat, ale Polska jest już zajęta… hmm…Przyznam, że poświęciłem Scope Fluidics ponad dwa lata analiz i wydaje mi się, ze znam merytorycznie spółkę dość dobrze, może jest w tym jakaś myśl, jakaś głęboka strategia, ale ja tego nie potrafię dostrzec. PodsumowanieCzy wierzę, ze spółka dokończy i sprzeda swoje rozwijane dwa systemy diagnostyczne? Tak i słowo wierzę, nie jest dobre w tym miejscu, to długotrwała znajomość spółki, ludzi, kompetencji. Wiele poświęconych godzin na monitoring czynionych działań, daje mi dość spore prawdopodobieństwo, że tak się stanie. Kiedy? Niestety tego nie wiem. Nie wie tego oczywiście i sama spółka a przesuwanie kolejnych terminów i ,w moim rozumieniu, niejasne komunikaty nie ułatwiają zadania. Za jaką cenę ? Znowu trudno powiedzieć, jaka będzie cena transakcyjna bo pandemia czyli możliwość zarobienia bardzo dużych pieniędzy na produkcji analizatorów i a przede wszystkim testów uaktywniło bardzo dużo różnych podmiotów na rynku. Często oferują one mierną jakość, ale agencjom rządowym to niespecjalnie przeszkadza w kupowaniu tego, wobec tego wiele miejsca jest już na rynku po prostu zajęte. Pojawia się pytanie na ile potencjalny nabywca dostrzeże jakość czterogenowego panelu Scope i możliwość rozwijania w ramach systemu innych paneli np.: MRSA, wirusowych i innych. Czy wcześniej nie kupił już czego innego, na co wydał pieniądze i zachce to rozwijać – pojawia się bardzo dużo zmiennych tej transakcji. Jest też rzeczą oczywistą, że sprzedaż jednego z projektu powinna spowodować wzrost wartości spółki (oczywiście wszystko zależy od uzyskanej ceny i wynegocjowanych warunków) , ale z inwestorskiego punku widzenia ryzyk po drodze jest co niemiara. Część z ich nie leży po stronie spółki, niektóre jednak leżą i tak to oceniam. Na koniec, marzeniem moim jest, aby Scope Fluidics znów zamieniła się w spółkę, w którą uwierzyłem analitycznie, z logiczną i biznesowo spójną strategią oraz z czytelną i jasną komunikacją, której powrotu będę z nadzieja wypatrywał. W ten sposób wyłącznie buduje się wartość na długie lata do akcjonariuszy, a o to chyba w tym chyba chodzi, przynajmniej ja chcę takiego rynku kapitałowego. Ten jak i wszystkie moje poprzednie wpisy zebrane zostały na stronie https://growthinvestment.pl/.
|
|
Temat:
PURE
Inwestorskie spojrzenie na e-konferencję aptamerową "Jak Pure Biologics buduje wartość w oparciu o technologie aptamerowe", która odbyła się w dniu 15.10.2020r.
Z założenia konferencja ta była konferencją edukacyjną, jednak wydaje się oczywistością, że znajomość merytoryczna projektów i ich postępów w spółkach biotechnologicznych przekłada się na inwestorską ocenę prawdopodobieństwa sukcesu, dlatego też przedstawię kilka ważnych myśli z tej konferencji. Na początku prezes F.Jeleń pokazał dwa strategiczne obszary „dywizje” w których spółka działa – aptamery i przeciwciała w tym : trzy projekty lekowe oparte na przeciwciałach, jeden projekt lekowy oparty na aptamerach i dwie terapie pozaustrojowe oparte na aptamerach. Ta dwugodzinna konferencja została poświęcona wyłącznie aptamerom, czyli obszarowi który nie był dotąd zewnętrznie szeroko omawiany dla inwestorów. Przypomnę tylko, że aptamery to sztucznie wyprodukowane krótkie fragmenty, zbudowane z tego samego materiału co DNA. Przypominają one w bardzo wielu aspektach przeciwciała i mogą być zastosowane jako cząsteczki terapeutyczne i diagnostyczne.
W trakcie konferencji przedstawiono główne osoby odpowiedzialne za projekty aptamerowe w Pure Biologics wraz z konsultantami naukowymi prof. Bogusław Paradowskim, oraz prof. Konradem Rejdakiem, prof. Günterem Meyerem. Po niezbędnym krótkim wprowadzeniu tematu dr Przemysław Jurek, omówił obszary w jakich rozwijane są aptamerowe projekty PB tj. pozaustrojowe terapie z aktywnymi filtrami molekularnymi oraz celowane nośniki leku tzw. koniugaty Aptamer-Lek. Koniugaty nośnik-lek to kompleksy, które zawierają nośniki leków, z którymi lek jest wiązany. Wiązaniu leku z nośnikiem często towarzyszy zmiana jego dystrybucji poprzez zwiększeniu kumulacja w tkance docelowej. Skutkuje to większym stężeniem leku w tkankach docelowych niż w przypadku podawania wolnego leku.
Spółka celuje w choroby rzadkie gdzie bariery rejestracyjne, procedowanie i prowadzenie badań jest łatwiejsze, wiec można je szybszej i prościej skomercjalizować. Terapie pozaustrojowe realizowane w spółce to PB002 (choroba Devica czy inaczej NMO) i PB005 (choroba miastenia). Ideą tych terapii jest stworzenie filtru wychwytującego z plazmy pacjenta określone białka patogenne, wywołujące daną chorobę. Taki filtr wystarczy potem włożyć do konkretnej maszyny przeznaczonej do aferezy (odseparowania z krwi patogennych czynników). Ta procedura medyczna i sprzęt znany i używany od wielu lat a więc „jedynym problemem” jest stworzenie specyficznego filtra a całą resztą – promocją, dystrybucją itp. zajmą się firmy, które produkują i dostarczą do szpitali takie maszyny. Ideą biznesową wobec tego jest podpisanie umowy parteringowej z firmą dostarczającą taki sprzęt do szpitali. To czterech głównych światowych graczy, którzy równocześnie monopolizują też rynek tj. jak szpital kupuje od nich maszyn, to musi dalej kupować filtry. Podsumowując, ciekawe jest to, że istnieje gotowa infrastruktura do rozwijanych przez PB terapii pozaustrojowych na całym świecie.
Projekt PB002 przygotowuje się obecnie do badań przedklinicznych w I półroczu 2021r. Prof. Bogusław Paradowski konsultant naukowy, praktyk lekarz zajmujący się na co dzień chorobą Devica wystąpił w czasie konferencji, gdzie opowiedział o samej chorobie i o tym, co mógłby zrobić taki specyficzny filtr tworzony właśnie przez Pure Biologics. Co ciekawe obecne badania w projekcie PB002 (pomimo tego, że są one od strony formalnej na etapie przed badaniami na zwierzętach) prowadzone są już nie in-vitro czyli na komórkach czy linach komórkowych, ale na konkretnym osoczu klinicznym pobranym od chorych na tą chorobę czyli można w praktyce sprawdzić, czy to działa czy też nie. I spółka jednoznacznie twierdzi, że filtr ten działa i wyłapuje białka patogenne, odpowiedzialne za tę chorobę. Ostatnio wyniki swoich badań przedstawili na jednej z największych konferencji aptamerowych w Oxfordzie.
Drugi projekt PB005 też opiera się na zasadzie aferezy, tj. stworzenia filtra, którego zadaniem jest wychwycenie specyficznego białka odpowiedzialnego za chorobę miastenię i włożenie go do maszyny do aferezy. Na konferencji Prof. Konrad Rejdak, prezes Polskiego Towarzystwa Neurologicznego opowiedział o tej chorobie a potem o pomyśle i badaniach Pure Biologics. Wg. Pana prof. „dają głęboka nadzieję…, wierzy głęboko, ze będzie to nowy kierunek” Sam projekt jest na wcześniejszym stopniu badań niż projekt PB002, jednak jak mówi kierownik projektu, wyniki są bardzo obiecujące. Trzeba też pamiętać, ze projekt PB002 „przeciera szlaki” a przy identycznej idei jak PB005 zespoły nabywają kompetencji, dlatego też każdy kolejny powinien być realizowany szybciej i sprawniej.
Na koniec omówiono projekt AptaMLN czyli projekt zastosowania aptamera jako nośnika leku nowotworowego. Tego rodzaju terapie celowane konugat z lekami (przeciwciało-lek) są już zarejestrowane na rynku a kilkaset jest w przedklinice oraz w badaniach klinicznych. Taki koniugat tworzy chociażby znana na polski rynku firma astra Zeneca. Projekt AptaMLN celuje w czerniaka, który zajmuje 5 miejsce wśród nowotworów na świecie- 300 tys. przypadków wobec szacowanych za 10 lat dwukrotnie większej ilości.
Podsumowując – dla mnie osobiście, konferencja była bardzo ciekawa, ze względu na przedstawione bardzo szczegółowo projekty aptamerowe i ich postępy. Niezwykle ważne było też potwierdzenie sensowności rozwijanych projektów przez spółkę poprzez profesorów medycyny, praktyków i uznanych autorytetów, którzy tymi chorobami zajmują się, na co dzień. Wielu specjalistów podkreśla, że aptamery mogą stać się „czarnym koniem” biotechnologii a przynajmniej rozwijać się bardziej dynamicznie niż przeciwciała, ze względu na swoje unikalne właściwości. Sto osobowy zespół Pure Biologics (z czego 40% z tytułem dr), wydaje się, że rozwinął i pogłębia kompetencje w tym zakresie.
Praktycznie dla inwestora – wydaje się, że z projektów aptamerowych można by zrobić oddzielną firmę w Pure Biologics ale jeśli występują w firmie razem z projektami leków opartych na przeciwciałach to większa ich ilość stanowi większe prawdopodobieństwo sukcesu. Które z nich dojdzie/i czy dojdzie do etapu komercjalizacji czyli parteringu to oczywiście się dopiero okaże, ale moim zdaniem inwestor powinien się posługiwać prawdopodobieństwem tego czy jest na to szansa czy też nie. A na szacowanie tego prawdopodobieństwa wpływa przede wszystkim obserwacja postępu prac i ilość realizowanych projektów. To z jednej strony jest dość proste a z drugiej wymaga określonej wiedzy, którą można zdybywać na takich konferencji jak ta. Zapowiedziano też za kilka tygodni podobną konferencję o przeciwciałach i postępie prac, dlatego też każdy inwestor zainteresowany inwestowaniem w biotechnologię powinien ją obejrzeć, ja na pewno też to zrobię.
|
|
Temat:
PURE
|
|
Temat:
PURE
Ogłoszenie Pure Biologics zapotrzebowania wykonania usługi badań przedklinicznych projektu lekowego MultiBody PB001 Regularnie przeglądam Bazę Konkurencyjności w zakresie spółek, które są w moim zakresie zainteresowania. To bardzo interesująca lektura, dzięki której inwestor może znaleźć wiele ciekawych faktów. Właśnie natrafiłem na ogłoszenie Pure Biologics „Usługa polegająca na przeprowadzeniu badań przedklinicznych substancji badawczej- badania in vivo na modelu zwierzęcym”. Chodzi oczywiście o badania przedkliniczne projektu lekowego PB001 Multibody. Pełen tekst ogłoszenia znajduje się pod linkiem bazakonkurencyjnosci.funduszee...
|
|
Temat:
PURE
Temat aptamerowy PB002. Jak kiedyś pisałem- to mniejsze ryzyko, w przypadku projektów terapeutycznych wynika m.in. z tego, że wchodząc do badań przedklinicznych a potem klinicznych, można mieść wysoką pewność powodzenia takich badań ponieważ skuteczność projektu może być bardzo dokładnie sprawdzona w laboratorium na materiale takim, jaki będzie wykorzystywany w czasie badań klinicznych np.: pozyskanej krwi lub osoczu chorych pacjentów. Proste.
|
|
Temat:
PURE
W nazwiązaniu do wczorajszej konferencji. To była typowa konferencja jedno godzinna, wśród innych spółek, „wszystko od początku ”, więc nie mogło być nic przełomowego. Terminy wchodzenia poszczególnych tematów do przedklinki potwierdzone, kolejność podobnie. Dowiedzieliśmy się, że badania przedkliniczne jest to pakiet kilku dużych badań. Np.: w przypadku PB001, na początek są pilotowe niewielkie badanie przez 3 m-ce + czas raportowania, ale to nie wyczerpuje pakietu badań przedklinicznch, które potrwają co najmniej przez cały 2021r. Jak śledzić prawdopodobieństwo parteringu ? jak będzie informacja, że pakiet badań (np.: pierwszy) został zakończony przez podmiot, który to dla nich wykonywał i wyniki są pozytywne wtedy taka transakcja zaczyna się uprawdopodobniać.
Nowością jest dla mnie jest jakiś przebłysk nowych tematów. Powiedzieli, że sytuacja epidemiologiczna bardzo im pomogła, wzrosło znaczne zainteresowanie przez zewnętrzne podmioty operujące na rynku projektami z rozwojem aptamerów. Spotykają się i prowadzą bardzo ciekawe rozmowy w tym zakresie. Wydaje się, że dość mocno byli tą perspektywą podekscytowani. Szczegółów będę pewnie poszukiwał na tych dwóch konferencjach, na które zapraszali i które jak podali odbędą się w terminach okołoemisyjnych.
Ktoś, gdzieś napisał, że na webinarze było niewielu inwestorów. Ja uważam, że nie ma się co dziwić, to biotechnologia, problematyka chyba najtrudniejsza na rynku i niewielu ludzi chce się „wnikać”, łatwiej obserwować inne tematy i masowo szukać poparcia swoich tez na rożnych forach. Każdy inwestuje w swój własny sposób, osobiście, bardzo lubię taką sytuacje, bo potem po czasie, jak zainteresowanie wzrasta ponieważ spółka zaczyna realizować swoje tematy i wszystko jasne co do przyszłości, także, a może przede wszystkim w cenach, można szykować się do wyjścia… :)
|
|
Temat:
PURE
Aptamery w Pure Biologics, czyli druga rozwijana poza przeciwciałami grupa związków, i czy na tym można zrobić biznes ? Inwestorzy śledzący spółkę Pure Biologics skupiają się przede wszystkim na projektach lekowych i bardzo dobrze bo to one na dzisiaj generują zasadniczą wartość spółki. Jednak należy pamiętać też o aptamerach, drugim rozwijanym w niej segmnciencie. Przyznaję, że ja też do niedawana, nie przywiązywałem do aptamerów zbytniej uwagi, a o ich istnieniu przypomniała mi ostatnia konferencji Aptamers 2020, organizowana przez International Society on Aptamers w Oxfordzie, w której też uczestniczyli przedstawiciele spółki. Konferencja w Oxfordzie jest poświęcona wyłącznie aptamerom i jak się okazuje, jest jedną z najważniejszych na świecie w tej dziedzinie, zaintrygowało mnie to, pokusiłem się więc o wykonanie dokładniejszego researchu. O praktycznym znaczeniu aptamerów niewiele wiadomo, więc na początek postanowiłem wystąpić o ujawnienie posteru prezentowanego przez spółkę na konferencji. I rzeczywiście taka odpowiedź została udzielona a poster został ujawniony infostrefa.com/infostrefa/pl/w... To był start mojego „śledztwa aptamerowego”, całą resztę można przeczytać w poniższym tekście. Zdaję sobie sprawę z faktu, że nie wszyscy pewnie będą chcieli cały test dokładnie czytać bo to oczywiście trudna dla laika materia. Do tego rynek polski i rynki bazowe są w chwili obecnej w słabym statystycznie okresie jesiennej zmienności, dodatkowo przed wyborami prezydenckimi USA , gdzie ciężko jest inwestować w ogóle na rynku a jeszcze trudniej robić to w branże takie jak biotechnologia. Moim jednak zdaniem systematyczne pogłębianie wiedzy jest niezbędne aby być skutecznym inwestorem w tej dziedzinie, a o to chyba chodzi w inwestowaniu, prawda? Powodem jest oczywiście to o czym wielokrotnie pisałem ale jeszcze raz powtórzę, iż moim zdaniem branża biotechnologiczna, med-tech oraz high-tech mogą się stać za kilka lat hitem polskiego rynku. Wcześniej czy później dysproporcja pomiędzy rynkami rozwiniętymi a rynkiem polskim zostanie po prostu „zasypana”. To, że tak się stanie, w moim przekonaniu jest wysoce prawdopodobne. Wtedy też, podobnie jak dzisiejsza „moda” na spółki gamingowe przyjdzie „moda” na takie spółki co będzie wiązało się z przepływem kapitału na te walory. Oczywiście wiem, że do tego jest potrzebny duży , spektakularny sukces/sukcesy, jednak wg. mnie to jedynie kwestia czasu. Trzeba też oczywiście pamiętać, że ten rodzaj inwestowania wymaga specyficznej wiedzy i trzeba ją zdobywać tu i teraz. 1) Na początek przede wszystkim ustalmy co to są te aptamery ? Aptamery to sztucznie wyprodukowane krótkie fragmenty, zbudowane z tego samego materiału co DNA. Przypominają one w bardzo wielu aspektach przeciwciała i mogą być zastosowane jako cząsteczki terapeutyczne i diagnostyczne. Przypomnę, że w Pure Biologics realizowane są dwa rodzaje projektów badawczo- rozwojowych : projekty rozwoju leków oparte na przeciwciałach, oraz projekty terapii pozaustrojowych oparte na aptamerach. Tyle definicji, a z praktycznego punktu widzenia ? Właściwości aptamerów powodują, że mogą być one zastosowane tam, gdzie przeciwciała nie są najlepszym rozwiązaniem, lub alternatywnie mogą te przeciwciała zastępować. Tym samym mogą stać się grupą której znaczenie w rozwoju leków, testów diagnostycznych i wyrobów medycznych będzie rosnąć. Główne przewagi aptamerów nad przeciwciałami to:- utrzymanie tej samej jakości między partiami produkcyjnymi dzięki syntezie (złożeniu) na drodze chemicznej, co jest trudne w przypadku białek (przeciwciał); - stosunkowo łatwa skalowalność produkcji; - brak obecności bakteryjnych czy wirusowych zanieczyszczeń bardzo często związanych z produkcją przeciwciał - niska lub zerowa immunogenność czyli pełna „akceptacja” przez układ odpornościowy - mniejszy rozmiar pozwalający dotrzeć do "ukrytych" celów molekularnych; - możliwość łatwej regulacji czasu krążenia w krwiobiegu - wysoka stabilność w różnych warunkach i długi czas przydatności do użycia - łatwość modyfikacji chemicznych, zwykle nie powodujących utraty stabilności jak w przypadku białek Ponadto, aptamery charakteryzują się niewielką (niemal zerową) zmiennością pomiędzy partiami produkcyjnymi, co jest nieosiągalne w przypadku białek. Dodatkowo, są wysoce stabilne w różnych warunkach środowiskowych. Dlaczego więc, jeżeli aptamery są takie dobre i przewyższają swoimi niektórymi właściwościami przeciwciała, nie są masowo stosowane, a spółka prowadzi trzy projekty lekowe oparte na przeciwciałach a wykorzystanie aptamerów zaczyna tylko od projektów terapeutycznych ? Otóż dlatego, że leków opartych na aptamerach na świecie jest zaledwie kilka, a wszyscy wielcy producenci świadomi właściwości aptamerów pracują dopiero nad tym. Spółka weszła na drogę aptamerowych projektów terapeutycznych aby zdobywać doświadczenie, będące podstawą przyszłych bardziej rozszerzonych projektów np.: lekowych. Ponadto projekty terapeutyczne oparte na aptamerach rozszerzają portfiolio spółki, pozwalając przy o wiele mniejszym ryzyku osiągnąć sukces tj. podpisać umowę komercyjną i wejść na rynek, czyli uwiarygodnić spółkę. To mniejsze ryzyko, w przypadku projektów terapeutycznych wynika m.in. z tego, że wchodząc do badań przedklinicznych a potem klinicznych, można mieść wysoką pewność powodzenia takich badań ponieważ skuteczność projektu może być bardzo dokładnie sprawdzona w laboratorium na materiale takim, jaki będzie wykorzystywany w czasie badań klinicznych np.: pozyskanej krwi lub osoczu chorych pacjentów. W Pure Biologics najbardziej zaawansowany jest projekt aptamerowy terapeutyczny PB002 AptaPheresis. To projekt, którego celem jest opracowanie terapeutycznego wyrobu medycznego wykorzystującego aptamery w procedurze aferezy (odseparowania z krwi patogennych czynników) do leczenia choroby neurodegeneracyjnej – Zespołu Devica (lub NMO). Co ciekawe, jak pisze spółka w swoich raportach, AptaPheresis „przeciera drogę dla innowacyjnego zastosowania aptamerów w terapiach pozustrojowych dla chorób neurologicznych opartych na filtrach biomolekularnych”. Stan zaawansowania prac wg. raportu za II kw- spółka przygotowuje się do uruchomienia prototypowej kolumny, prowadzone są obecnie prace nad wyborem najlepszego złoża oraz najwydajniejszego sposobu wiązania do niego zoptymalizowanego aptameru, Chodzi tu o wyeliminowanie przypadkowego uwalniania się aptameru ze złoża do krwiobiegu pacjenta. Optymalizowane są procedury do przeprowadzenia testów przepływu osocza (prędkość ml/min, ciśnienie) przez złoże oraz jego stabilności podczas aferezy, z czym wiąże się także kontrola ilości uwolnionego z kolumny aptameru do osocza. Prowadzone są również prace nad sposobem sterylizacji kompletnej kolumny, a także ewentualnej możliwości jej regeneracji w trakcie lub po procedurze aferezy ( co podnosi efektywność/skutecznoć jednego zabiegu). Afereza i jej rynek rozwoju na świecie, czyli moja próba połączenia tworzonych przez PB diagnostycznych kolumn aptamerowych z biznesemPrzyznam, że tutaj było mi dość ciężko znaleźć cokolwiek, ale trochę udało się ustalić. Rynek aferezy szacowany jest na 1,7 miliarda USD i ma rosnąć 8% r/r, do około 2,7 miliarda w 2025, link do podglądu raportu www.marketsandmarkets.com/Mark... . Trafiłem też na firmy, które robią produkty do aferezy i z jednego raportu są wymienione takie jak : Miltenyi Biotec, Fresenius, Terumo, Baxter, Medica Group Zwróciły moją uwagę : Fresenius i Terumo. To bardzo duże spółki, które robią sporo medycznych urządzeń i nie są to leki. Nazwy te pojawiały się u Pure w przeszłości na prezentacjach przy opisie rynków docelowych ale nie sądzę, żeby coś było na rzeczy już na tym etapie. Faktycznie jednak na stronach Freseniusa czy Miltenyi widać, że biznes aferezy składa się z maszyn, które pompują krew i osobno kolumn, które się do nich instaluje jak kartidże do drukarek - o tym mówił Pure nie raz, że oni chcą tylko zrobić kolumnę, która sprzedadzą komuś, kto ma już swój system do aferezy. Można więc chyba założyć, że odbiorcą musi być któraś z tych dużych firm siedzących w aferezie. To by było logiczne i bizesowo uzasadnione działanie, no i informacja o takim dealu na pewno by się pozytywnie rozpropagowała po rynku. Równoległe w PB testowanie jest zastosowanie ąptamerów jako nośników leków w terapiach wewnątrzustrojowychDla pełnego obrazu rozwoju projektów aptamerowych spółki zwracam też uwagę na projekt PB006 (AptaMLN) : „Opracowanie nowej metody terapeutycznej czerniaka opartej na nośniku aptamerowym”, „W ramach projektu przeprowadzone zostaną badania typu dowodu koncepcji (ang. proof-of-concept, PoC) kandydata na lek opartego o nośnik aptamerowy w koniugacie z lekiem cytotoksycznym. Strategia celowanej terapii w leczeniu czerniaka zakłada opracowanie nowego aptameru specyficznego wobec wybranego receptora nadekspresjonowanego w komórkach czerniaka oraz niektórych innych nowotworach.” Testowanie takiego zastosowania aptamerów może być alternatywą da wykorzystywanych w tym celu przeciwciał jak ma to miejsce np. w badaniach prowadzonych przez znaną firmę farmaceutyczną Astra Zeneca (jednej z największych na świecie i znajdująca się w światowej czołówce tego sektora). Link www.astrazeneca.pl/zdrowie-i-c... dalej Przeciwciała skoniugowane z lekiem. Polecam do obejrzenia wideo, uświadamia laikowi o co w tym chodzi www.astrazeneca.pl/zdrowie-i-c... Tzw. Koniugaty nośnik-lek to kompleksy, które zawierają nośniki leków, z którymi lek wiązany. Wiązaniu leku z nośnikiem często towarzyszy zmiana jego dystrybucji poprzez zwiększeniu kumulacja w tkance docelowej. Skutkuje to większym stężeniem leku w tkankach docelowych niż w przypadku podawania wolnego leku. Mimo, że są to bardzo perspektywiczne koniugaty, nie są jeszcze dostępne na rynku, a badania nad nimi trwają. 2) Jak wspominałem na początku spółka udostępniła poster z ostatniej konferencji aptamerowej w Oxfordzie Wybrane fragmenty postera , tłumaczone z języka angielskiego Zadania projektowe obejmują opracowanie filtra biomolekularnego oraz przetestowanie tego wyrobu medycznego w badaniu klinicznym. Przebadany produkt wraz z dokumentacją będzie gotowy do rejestracji przez licencjobiorcę. Opracowywany w projekcie wyrób medyczny obejmuje filtr biomolekularny do aferezy, wewnątrz którego znajdują się cząsteczki aptameru wysoce specyficznie rozpoznające tylko wybraną patogenną molekułę. Dzięki temu zastosowanie aptamerowego filtra podczas terapeutycznej procedury aferezy pozwoli na usunięcie czynnika chorobotwórczego przy równoczesnym znaczącym lub wręcz całkowitym ograniczeniu skutków ubocznych terapii NMO. Opracowywany w projekcie AptaPheresis wyrób medyczny pozwoli na prowadzenie terapii, która będzie pierwszym w klasie podejściem celującym w białka bezpośrednio wywołujące zmiany patologiczne u pacjentów cierpiących na Zespół Devica. Co ważne, na rynku nie istnieje bezpośrednie podejście konkurencyjne do leczenia tej choroby, którego wprowadzenie dodatkowo pochłaniałoby tak niewiele kosztów w stosunku do rozwoju klasycznej substancji farmakologicznie czynnej (leku). Pokazano na obrazach mikroskopowych efekty usuwania patogennych autoprzeciwciał z osocza, bez interakcji z innymi białkami osocza. Podkreślono, ze projekt jest planowany do wejścia do badań in vivo (na zwierzętach – badania przedkliniczne) w 2021 r. Kto uczestniczył w konferencji – jednostki naukowe (w tym topowe uniwersytety – Stanford, Duke, Cornell, Oxford) oraz niektóre największe firmy farmaceutyczne z całego świata, dokładna lista jest podana na libpubmedia.co.uk/aptamers-202... (widać tam np. Roche, GlaxoSmithKline, Alexion) Na konferencji wystawiały się też m.in.: Aratinga.bio, zajmująca się immunoterapią (czyli to co Pure robi z przeciwciałami), i Somalogic (srebrny sponsor), która robi zaawansowaną diagnostykę. Na stronie konferencji można też zauważyć, że PB też wystąpiła jako srebrny sponsor. To chyba jedyna droga do sukcesu w tej branży - rozpoznawalność oraz budowanie wizerunku, naturalnie poparte dokonaniami naukowymi. Podane kontakty umożliwiają pozyskiwanie badań kontraktowych z tego zakresu jako budowanie kompetencji i doświadczeń. Tematyka konferencji – Znakomicie sobie zdaję sprawę, że zdecydowanej większości inwestorów nic te tytuły nie powiedzą, jednak chciałem pokazać jak szerokie jest spektrum wykorzystania aptamerów. Widać, że główne kierunki to diagnostyka i immunoterapia właśnie. Była też m.in. prezentacja o przeciwzapalnych lekach z aptamerów profesora Guntera Mayer z Niemiec, jednego z czołowych światowych naukowców zajmujących się aptamerami który jest też konsultantem PB (Rada Naukowa). Niektóre z tytułów wystąpień : „Aptameryczne biosensory do wykrywania patogenów i toksyn”, „Identyfikacja i charakterystyka aptameru RNA, który wywołuje aktywację komórek” , „Projekt dwumiejscowych aptamerów wiążących kokainę” „Sekwencyjne i kontrolowane składanie nanocząsteczek aptameru do dostarczania leków” 3) Konkluzja - dlaczego aptamery są takie ciekawe i czy można na tym robić biznes, czyli to co tak naprawdę interesuje inwestora ?W chwili obecnej bardzo niewiele spółek w Europie pracuje nad komercyjnym wykorzystania aptamerów. Dlaczego ? ponieważ są do tego potrzebne : kompetencje czyli ludzie oraz lata doświadczeń. Wielu specjalistów podkreśla, że aptamery mogą stać się „czarnym koniem” biotechnologii a przynajmniej rozwijać się bardziej dynamicznie niż przeciwciała, ze względu na swoje unikalne właściwości. Dlatego też wydaje się, że Spółka ma w tej dziedzinie spore szanse rozwoju. Posiada własną platformę technologiczną PureApta tworzącą modyfikowane aptamery, (na którą ma patent w USA) i może oferować usługi zewnętrzne (w tej branży usługi zewnętrzne to tez a przede wszystkim budowanie kompetencji i zdobywanie doświadczeń). Na razie inwestor powinien śledzić oczywiście przede wszystkim projekty lekowe spółki bo one generują wartość. Jednak należy pamiętać o aptamerach bo to druga rozwijana droga w Pure Biologics, nie na teraz ale na obiecującą przyszłość. Przyszłość ta, w pierwszym kroku, już za kilka/kilkanaście miesięcy może być już potencjałem do skomercjalizowania w aptamerowych projektach terapeutycznych. 4) Ryzyka, czyi coś w rodzaju diclaimera, które będę dopisywał na końcu do każdej spółki innowacyjnej. Wielu znajomych inwestorów w rozmowach z mną wspomina, że za mało podkreślam znaczenia ryzyk spółek które opisuję, dlatego ten element będzie stałym, odrębnym, fragmentem każdej mojej analizy.Biotechnologia , w tym przypadku Pure Biologics - czy są ryzyka ? – tak, to spółka, która do tej pory jeszcze nie miała komercjalizacji, a gdyby nawet miała, to i tak trzeba pamiętać, że to obszar biotechnologii czyli programów badawczych i ryzyka bardzo wyraźnie istnieją. Najważniejsze ryzyka to : zatrzymanie lub przesuwanie terminów badań, brak finansowania lub odejście kluczowych osób. Ale, żeby być obiektywnym, w przypadku tej spółki trzeba też pamiętać, że ryzyka te są zarządzane i ograniczane na kilka sposobów – spółka posiada 6 programów badawczych dofinansowanych w 75% przez NCBiR Pierwszy program lekowy oraz program aptamerowy będą wchodziły w fazę przedkliniczną na przełomie 2020 i początku 2021, po nich będą wchodziły kolejne dwa programy lekowe w odstępach półrocznych. Faza przedkliniczna jest ta fazą, która dla leków biologicznych z immunoonkologii jest charakterystyczna do zawierania umów parteringowych. Dodatkowo jest duży program motywacyjny, którym objęci są wszyscy pracownicy spółki. Dlatego z inwestorskiego punktu widzenia bardzo ważnym jest, że ryzyka te można łatwo monitorować i kontrolować. Na końcu oczywiście będzie „sprawdzam” czyli pierwsza i kolejne zapowiadane komercjalizacje badań.Z dodatkowych ryzyk trzeba pamiętać, że spółka jest na NewConnect co oznacza niską płynność, możliwe bardzo duże wahania zmiany wartości akcji w szczególności przy określonych komunikatach – zarówno pozytywnych jak i negatywnych. Pamiętajmy jednak że spółka wchodzi za kilka miesięcy na GPW i ten stan będzie się zmieniał.
|
|
Temat:
SCPFL
Jakie testy stosować i kiedy ? Nie jest to tekst idealny, brak poruszanych wielu ważnych kwestii, ale na poziomie elementarnym (ukazał się w Kurierze Medycznym piśmie dla lekarzy) jest ok. Warto przeczytac. www.termedia.pl/koronawirus/Ja...
|
|
Temat:
PURE
Kilka dni temu analizę spółki po II kw wykonał Analityk Fundamentalny a teraz moje , nieco w inny sposób zrobione, spojrzenie na spółkę Pure Biologics po raporcie za II kw 2020r oraz po Walnym Zgromadzeniu Akcjonariuszy
Byłem obecny na ostatnim WZA i jestem po lekturze raportu za II kw 2020 , kilka moich uwag, gdzie spółka jest obecna i dokąd zmierza, ponieważ moim zdaniem miejsce w który się znalazła jest niezwykle ważne, zarówno dla akcjonariuszy jak i dla samej spółki. A te dwa zdarzenia tj. WZA oraz raport za II kw pozwalają wysunąć wiele interesujących wniosków.
I. Na początek uwagi po Walnym Zgromadzeniu Akcjonariuszy, które odbyło się w czerwcu br w siedzibie spółki .
Najważniejsze uwagi w telegraficznym skrócie
- Straty z poprzednich lat przechodzą rok/rok i jak przyjdzie przychód będą działać jak tarcza podatkowa
- zmiana statutu : Rada Nadzorcza „przejmuje pieczę” nad programem motywacyjnym, statut został całkowicie „przebudowany” pod kątem rynku regulowanego.
- zmiany statutu : generalnie więcej przejrzystości w spółce i uprawnień dla Rady Nadzorczej. Za pomocą RN wprowadza się pełną określoną statutem kontrolę na Zarządem
- pytanie z sali o emisję: cena emisji będzie uzależniona od book-buildingu i aktualnej sytuacji na rynku, prawdopodobny termin : IV kw – I kw 2020.
- pytanie z sali o to kiedy mogą być na GWP – robią wszystko aby było to jak najwcześniejale decyzje podejmą w stosownym momęcie współpracującą przy tym z kancelarią prawną„absolutny top” chodzi o międzynarodowe standardy dla potencjalnych inwestorów,
- zmiana statutu – Prezes Filip Jeleń rezygnuje z wszelkich uprawnień osobistych dotyczących zwiększonych uprawnień do obsadzania RN oraz Zarządu
- Prezes F.Jeleń – „największy kapitał to ludzie”. Rekrutacja prawie całkowicie ustała, mają zbudowany docelowy zespół, bardzo mocny program motywacyjny
- zmiana statutu- dywidenda : możliwa do wypłacenia z nadzwyczajnego zysku, jak się pojawi „atrakcyjna oferta” i zabezpieczą przyszłe koszty
- następne sprawozdanie zgodne z Międzynarodowymi Standardami Rachunkowości. Moje pytanie z jakich względów, odpowiedź - poza względami formalnymi GWP to łatwość rozmowy z funduszami z zagranicy
- konferencja naukowa przed emisją : spółka, zgodnie z dotychczasową praktyką, obiecała akcjonariuszom i inwestorom zorganizowanie kolejnej konferencji naukowej przed przeprowadzeniem emisji
Podsumowanie WZA: zmiany statutowe były robione ewidentnie po to aby spółka była bardziej transparentna. Inwestorzy instytucjonalni na których jak myślę bardzo liczy spółka w przyszłej emisji mają pewne określne wymagania formalne i celem WZA było tak zmienić statut, aby w tym zakresie nie było żadnych ograniczeń.
II. Raport po II kw. 2020
1) Liczby w raporcie
Podsumowanie tego co poniżej w pkt 1), dla osób, które nie chcą lub nie mają czasu się wgłębiać w szczegóły. Liczby w raporcie mówią o rozwoju spółki, projektów oraz aktywów trwałych. Zwracam tez uwagę na sposób myślenia „discovery first” – jak ludzie są potrzebni w badaniach, które mają przynieść spółce rozwój i pieniądze to odpuszczamy tą część biznesu tj. badania kontraktowe i skupiamy się na tym co naprawdę ważne. Generalnie: nowa prezentacja wyniku finansowego (MSR-y) pozwala wyodrębnić wyniki działalności kontraktowej i jej rentowność , pokazuje wyraźnie przychody z dotacji do projektów i koszty realizacji projektów B+R .W notach można znaleźć informacje szczegółowe.
- Przychody z usług komercyjnych
W pozycji przychody z usług komercyjnych jednostkowego sprawozdania z zysków i strat i innych całkowitych dochodów sporządzonego po raz pierwszy wg MSR/MSSF za II kw. 2020 r. Spółka wykazała wartość 94 tys. zł. W okresie porównywalnym tj. II kw. ubiegłego roku zanotowano 453 tys. zł. W ujęciu narastającym za dwa kwartały br. przychody z usług komercyjnych wyniosły 427 tys. zł. W strukturze sprzedaży przeważała sprzedaż krajowa, która w II kw. 2020 r. stanowiła 100% a narastająco po dwóch kwartałach 95%. Spadek wartości przychodów ze sprzedaży badań kontraktowych w bieżącym kwartale wynika w głównej mierze z realizacji projektów w obszarze badawczo rozwojowym (np. rozpoczęcie projektu PB006 AptaMLN, wejście w intensywna fazę prac laboratoryjnych projektu PB004 PureBike, itp.), a co za tym idzie wyłączenie części zasobów osobowych z prac w obszarze działalności komercyjnej.
- Koszty operacyjne
Wartość kosztów operacyjnych wynosząca 6 088 tys. zł w bieżącym kwartale (3 981 tys. zł w II kw. 2019 r., +53%) przedstawia zagregowane koszty poniesione przez Spółkę we wszystkich obszarach aktywności biznesowej tj. B+R i badania kontraktowe. Narastająco, po dwóch kwartałach 2020 r. Spółka wykazała 11 997 PLN kosztów operacyjnych (7 654 tys. zł po II kw. 2019 r., +57%). Głowna przyczyną wzrostu jest intensyfikacja prac B+R, kontynuowanie prac nad projektami, które w okresie porównywalnym jeszcze się nie rozpoczęły lub były w początkowej fazie prac.
W strukturze kosztów w bieżącym kwartale 78% (4 738 tys. zł.) stanowiły wydatki na projekty B&R w zakresie prac badawczych odnoszonych bezpośrednio w wynik, 5% (277 tys. zł) wydatki na prace B&R, które zostały kapitalizowane w bilansie. Są to prace rozwojowe nad platforma PureApta (PB010). Koszty ogólnego zarządu i sprzedaży stanowiły 17% (1 008 tys. zł) kosztów operacyjnych a koszt własny sprzedanych usług 1%. Zbliżone proporcje występują w odniesieniu do kosztów po dwóch kwartałach 2020 r.
W strukturze kosztów wg. rodzajów największą pozycję, 51,6% stanowią wynagrodzenia (3 143 tys. zł.), następnie zużycie materiałów i energii (21,9%, 1 336 tys. zł) oraz amortyzacja (13,1%, 796 tys. zł). Zbliżona struktura występuje również w ujęciu narastającym, gdzie wynagrodzenia stanowią 51,6% kosztów operacyjnych (6 193 tys. zł), zużycie materiałów i energii 18,8% (2 261 tys. zł). W porównaniu do drugiego kwartału 2019 r. struktura kosztów rodzajowych uległa największej zmianie w zakresie wynagrodzeń (+8 pp), co jest spowodowane wzrostem zatrudnienia kadry naukowej w celu realizacji prac nad projektami B+R.
- Przychody z dotacji
W pozycji przychodów z dotacji w II kw. br. Spółka wykazała 3 206 tys. zł i jest to 31% więcej niż w II kw. 2019 r. W ujęciu narastającym przychody z tytułu dotacji wyniosły 6 703 tys. zł to jest +38% w stosunku do pierwszego półrocza 2019.
- W II kw. 2020 r. Spółka odniosła w sprawozdanie z zysków i strat i innych całkowitych dochodów 4 738 tys. zł kosztów projektowych i jest to 1 363 tys. zł (+40%) więcej niż w okresie porównywalnym. W ujęciu narastającym po dwóch kwartałach br. koszty projektowe wyniosły 9 391 tys. zł i jest to 2 951 tys. zł (+46%) więcej niż w porównywalnym okresie roku 2019. Pokazuje to zwiększenie skali działalności B+R Spółki oraz systematyczne przechodzenie do kolejnych, coraz bardziej kapitałochłonnych etapów projektów. Analizując strukturę kosztów, największy udział (29%) w kosztach projektowych w II kw. 2019 r. ma PB004 – PureBike. Pozostałe cztery kluczowe projekty B+R wymienione wyżej wygenerowały łącznie 60% kosztów projektowych w II kw. 2020 r. W analogicznym okresie 2019 r. nie prowadzono jeszcze prac nad projektem PB004 – PureBike, a pozostałe cztery kluczowe projekty generowały 83% całości kosztów projektowych.
- Aktywa trwałe
W tej pozycji bilansowej wynoszącej w II kw. 2020 roku 7 924 tys. zł głównym składnikiem są: „Rzeczowe środki trwałe” w kwocie 7 111 tys. zł. W analogicznym okresie roku 2019 wielkości te wynosiły odpowiednio 5 971 tys. zł oraz 5 352 tys. zł.
Ujęta jest tu wartość aktywów informatycznych i wysoko zaawansowanych urządzeń laboratoryjnych służących do realizacji projektów B+R pozyskanych w formie długoterminowych umów i leasingu finansowego. W stosunku do wartości w II kw. 2019 r. nastąpił wzrost aktywów trwałych o 95%.
- Zobowiązania długoterminowe
Zobowiązania długoterminowe na koniec okresu sprawozdawczego wyniosły 5 379 tys. zł i są 48% większe niż na koniec 2019 roku. Zobowiązania te reprezentują w znaczniej mierze (5 144 tys. zł) długoterminową część umów leasingowych na sprzęt laboratoryjny podpisanych przez Spółkę w ostatnich kwartałach.
2) Rozwój projektów, czyli to co najważniejsze
Projekty lekowe i dlaczego to tyle trwa ?
Najważniejsze dla spółki są oczywiście projekty lekowe (w przyszłości mają generować największe przychody dla firmy i stanowić o jej wartości) to : PB001 MultiBody, PB003 PureActivator, PB004 PureBike. Wszyscy pamiętamy, że pierwsza cząsteczka PB001 Multibody ma na przełomie roku wejść do badań przedklinicznych na zwierzętach, potem w odstępach półrocznych mają wchodzić kolejne. Jest rzeczą bezcelową abym z raportu kopiował opisy postępu prac. Również nie podejmuje się ich szczegółowego tłumaczenia, język naukowy łatwo jest przekręcić, a każdy może sam to w raporcie doczytać. To trudne opisy, przeciętny inwestor musi zadać sobie trud aby przez nie przejść i spróbować je zrozumieć . Co zrozumiałe, szczegółowo robi to bardzo mało osób lub nawet skrajnie mało. Ja zaliczam się do takich osób i uważam, ze warto - z kwartału na kwartał dokonuję swoje dokładne analizy do każdego z projektów. Oczywistym jest, że niektóre z etapów projektów potrzebują więcej czasu , na co wskazuje lektura raportów oraz niektórzy inwestorzy w komentarzach, jednak mało kto zadaje sobie pytanie dlaczego ? Moje analizy oraz dodatkowe wyjaśnienia spółki jednoznacznie wskazują przyczynę – spółka na każdym etapie dodaje lub uzupełnia badania, które mają na celu zwiększyć prawdopodobieństwo sukcesu oraz jednocześnie zmniejszyć prawdopodobieństwo porażki. I tak – np.: zamiast pierwotnie założonych dwóch lub czterech przeciwciał, generują i testują kilkanaście, cały czas pracują nad kolejnymi. Główne przeciwciała „idą” zgodnie z harmonogramem i nie czekają na te nowe, ale to że cały czas są generowane nowe to oczywiście minimalizowanie ryzyka porażki w razie odrzucenia przeciwciał w dalszej części badań. Przeprowadzają tzw. testy funkcjonalne na pozyskiwanych liniach komórkowych – immunologicznych oraz nowotworowych i badają jest faktyczna odpowiedź immunologiczna organizmu. Generują swoje własne linie komórkowe używając do tego nowoczesne technologie. Wszystko po to, aby odwzorować warunki występujące w organizmie ludzkim i zweryfikować zakładany mechanizm działania, a po jego pomyślnym potwierdzeniu - skierować kandydatów do wstępnych badań przedklinicznych na zwierzętach- takich kandydatów, których prawdopodobieństwo na sukces jest największe. Spółka ma finanse na te dodatkowe badania i je konsekwentnie wykorzystuje. Zasada jest prosta - dopóki coś jest u nich w laboratorium- to mają na to wpływ i trzeba to maksymalnie dopracować, a jak wypuszczą na zewnętrz na badania przedkliniczne to kończy się ich rola. Dlatego trzeba to zrobić najlepiej jak to możliwe, wykorzystując wszelkie możliwe działania, zdobywane know-how oraz nowoczesne technologie.
Czy dla mnie to dobra strategia ? tak, bardzo dobra. Jeśli mam zaczekać 3 miesiące lub pół roku dłużej i uzyskać dobry wynik na zwierzętach , to nie ma o czy mówić. Jako inwestor nie potrzebuję wielkiego nadęcia i buńczucznych przechwałek ale konkretnego efektu. To oczywiście badania naukowe i biotechnologia dlatego wszystko może się zdarzyć, ale jeżeli robią wszystko aby zwiększyć prawdopodobieństwo sukcesu to ja to kupuję, ponieważ identycznie inwestuję na rynku i po wynikach wiem, że to dobra droga . Oczywiście na końcu będzie „sprawdzam” i rzeczywisty efekt w badanach przedklinicznych na zwierzętach, to już naprawdę niedługo. Raportowane efekty badań przedklinicznych będą przełomowym raportem spółki.
Projekty terapeutyczne – czyli projekty oparte na aptamerach.
Skupię się na najważniejszym i najbardziej zaawansowanym projekcie PB002, AptaPheresist, „przecierającym drogę dla innowacyjnego zastosowania aptamerów w terapiach pozustrojowych dla chorób neurologicznych opartych na filtrach biomolekularnych”. Spółka przygotowuje się do uruchomienia prototypowej kolumny, prowadzone są obecnie prace nad wyborem najlepszego złoża oraz najwydajniejszego sposobu wiązania zoptymalizowanego aptameru chodzi to o uwalniania się aptameru ze złoża do krwiobiegu pacjenta. Optymalizowane są procedury do przeprowadzenia testów przepływu osocza (prędkość ml/min, ciśnienie) przez złoże oraz jego stabilności podczas aferezy, z czym wiąże się także kontrola ilości uwolnionego z kolumny aptameru do osocza. Prowadzone są również prace nad sposobem sterylizacji kompletnej kolumny, a także ewentualnej możliwości jej regeneracji w trakcie lub po procedurze aferezy.
Jednocześnie Spółka prowadzi rozmowy z potencjalnymi podwykonawcami w sprawie realizacji badań przedklinicznych na modelu zwierzęcym.
Zwrócę jeszcze uwagę na dość znaczące zdanie, które znalazło się w innym fragmencie raportu „Modyfikacja podejścia Spółki do formy realizacji i sposobu finansowania projektów diagnostycznych”. Spółka w tym miejscu już we wcześniejszych raportach sygnalizowała model współpracy z partnerem branżowym w zakresie segmentu diagnostycznego i chyba zbliżamy się do finału tego rozwiązania.
Obecnie Spółka oczekuje na decyzje dotyczące pozyskania źródeł finansowania niezbędnych do rozpoczęcia projektu diagnostycznego przez potencjalnego Partnera Branżowego, w ramach którego możliwa będzie przyszła współpraca.
Procentujące zdobywane know-how
Jak powiedział prezes F.Jeleń „największy kapitał to ludzie”. Każdy kolejny projekt idący drogą PB001 MultiBody korzysta z jego doświadczeń. Zdobywane doświadczenie oraz know-how procentuje w kolejnych projektach, jest łatwiej i szybciej przy mniejszej ilości błędów. Bardzo podobnie jest przy projektach aptamerowych. Projekty naukowo-technologiczne rozwijane w konsorcjach PB007 Mara, PB008 MAGBBRIS nie przynoszą strat ponieważ są w całości pokrywane, ale doświadczenie, które spółka przy nich zdobywa będzie przenosiła w inne obszary badań własnych. Podobny mechanizm występuje przy zaawansowanych badaniach zleconych. Tak działają wszystkie największe i najbardziej rozpoznawalne biotechnologiczne ośrodki naukowe i to jest naprawdę największy kapitał spółki, ponieważ z dużą dozą prawdopodobieństwa powinno przełożyć się to, prędzej czy później na pierwszy i mam nadzieję jej kolejne sukcesy.
Czy przeciętny inwestor może oceniać spółkę biotechnologiczną
Już kiedyś o tym pisałem, ale może warto to przypomnieć. Pure Biologics to spółka z zakresu biotechnologii czyli dziedziny postrzegalnej przez inwestorów jako dziedzina wysokiego ryzyka. Oczywiście co do zasady statystycznej jest to dobre założenie. Jednak ja staram się specjalizować w takich innowacyjnych spółkach i uważam, że to właśnie one za kilka lat staną się hitem polskiego rynku w tym oczywiście m.in branża biotechnologiczna. Oczywiście chodzi o konkretne spółki (a nie przekrój rynku) po gruntownej analizie i przy ciągłym monitoringu o określonej na tej podstawie prawdopodobieństwie na sukces. Inwestorzy zagraniczni, którzy teraz inwestują w polskie nieruchomości lub kapitałem VC wchodzą w młode spółki niepubliczne wcześniej czy później wykorzystają dysproporcję pomiędzy swoim rynkiem a rynkiem polskim jak robili to w innych obszarach inwestycyjnych. Jak mówi Paweł Przewięźlikowski twórca Selvity - za nimi stoi 40 lat doświadczeń inwestowania w branże biotechnologiczną (np.: rynek amerykański) , nauczyli się jej, za polskimi inwestorami tylko kilka lat. To, ze tak się stanie , w moim przekonaniu jest wysoce prawdopodobne.
I tu pojawia problem, mocno dyskutowany przez inwestorów - kto może ocenić sens działań spółki zajmującej się biotechnologią : student medycyny lub biotechnologii - wątpię, absolwent tych kierunków- również głęboko wątpię. Projekty na dziesiątki mln przechodzą przez NCBiR gdzie analizowane są przez zespoły kompetentnych naukowców. Ponadto spółka taka jak Pure Biologics mając w swoim składzie kilkudziesięciu dr biotechnologii i nauk pokrewnych, z całego świata, pokazywała by tematy, bez naukowego lub komercyjnego sensu wystawiając się na śmieszność i podważając swój autorytet - oceniam to jako nieprawdopodobne. Tu moim zdaniem rzecz idzie czy mają szansę doprowadzić projekty do komercjalizacji – a to można monitorować analizowaniem działań spółki zarówno tych naukowych jak i biznesowych. Trzeba mieć w tym zakresie kompetencje to jasne , ale jak wszystko na tym świecie można je zdobyć, jest tylko kwestia poświęconego na to czasu.
Dla inwestorów, którzy nie mogę lub nie chcą poświęcić czasu na analizę postępu prac naukowych proponuję drogę pewnie niedoskonałą lecz pozwalającą szacunkowo się zorientować w postępie. To skumulowane wykresy graficznego postępu prac, które w każdym raporcie pokazują co się zmieniło i jaka droga pozostała do przebycia. Zdaję sobie sprawę, że spółce ciężko to dzielić na tygodnie i miesiące i nie można tego wymierzać, a w każdym z projektów każda graficzna „cegiełka” może mieć inny okres. Jak się domyślam spółce bardziej chodzi o to, żeby pokazać, co się dzieje oraz gdzie jesteśmy i żeby zorientować się ile jeszcze zostało do przedkliniki. Ja korzystam z tego w najprostszy możliwy sposób otwierając dwa raporty bieżący i poprzedni i porównując postęp prac w ostatnim okresie.
IV Emisja wraz z przejściem na rynek główny - jak będzie budowana, czemu ma służyć i kiedy ona będzie ?
Już kiedyś pisałem, iż przedstawiciele spółki wielokrotnie wypowiadali się, że ich miejsce jest na głównym parkiecie, wiec przejście na GWP wraz z wejściem pierwszego projektu z Discovery do Przedkliniki to logika i konsekwencja.
Wszystkie projekty komercyjne będą realizowane do końca 2023r (jeden do połowy 2023). Katalog projektów na dzisiaj jest zamknięty. Całkowita wartość projektów to 147 mln w tym dotacje 109,7, wkład własny 37,3 mln, częściowo już pozyskany oraz konieczny do pozyskania od inwestorów, właśnie w tej planowanej emisji która ma zamknąć wszelkie potrzeby finansowe spółki w zakresie wszystkich rozpoczętych projektów.
Czas emisji – kilku miesięcy miałem wątpliwości i dociekałem, że wszystko zależy od tego czy NCBiR utrzyma system zaliczkowania. Jeśli utrzyma - przyszła emisja miała pojawić się koniec 2020, początek 2021r, jeśli nie utrzyma i wróci do rozliczania zakończonych etapów, taki komunika ze strony spółki oznaczał by ,iż zaczynają się szykować do emisji. Obecnie, ponieważ system zaliczkowania z NCBiR-u jest utrzymany, sytuacja finansowa spółki jest bardzo dobra, mogą dowolnie wyznaczyć czas emisji (oczywiście rozsądnie w zakresie następnych 6-8 mc-y)
Ale przecież nie o same pieniądze chodzi, jesteśmy na określonym rynku, w określonych warunkach a wszystko w biotechnologii należy planować z dużym wyprzedzeniem. Na rynek główny szykują się inne spółki chociażby Allegro, na co niewątpliwie zostanie skierowany strumień pieniądza z funduszy. Trudno powiedzieć czy euforia jak jeszcze niedawno była na rynku nie zakończy się, chociażby ze względu np.: na korektę lub cos poważniejszego na rynkach bazowych co wpłynęłoby pewnie na emisję akcji. Wreszcie spółka jest w przededniu badań przedklinicznych, które będą realizowane na zewnątrz spółki i są bardzo poważnym kosztem a kontraktując je z pewnym wyprzedzeniem (co w dzisiejszych realiach jest koniecznością), zwyczajnie te pieniądze trzeba mieć.
Zważając na wszystko powyższe - jeśli miałbym zakładać z dużą dozą prawdopodobieństwa, czasem emisji byłaby jesień czyli najbliższe miesiące.
Oferującym akcje będzie BOŚ Dom Maklerski , wg. przedstawicieli spółki do wejścia na rynek główny mają współpracującą kancelarię prawną jak usłyszeliśmy na WZA „absolutny top”
Sprawozdanie za II kw 2020r zostało zrobione równolegle zgodne z Międzynarodowymi Standardami Rachunkowości. Jest oczywiste, iż wielu inwestorów instytucjonalnych chce mieć raporty realizowane w standardach międzynarodowych, aby wiedzieć, co się w firmie dzieje, aby była czytelna struktura wydawania środków, jakie inwestycje są realizowane , jakie są nakłady itd.
Cena emisji będzie ustalana w oparciu wśród inwestorów instytucjonalnych, czyli podobnie jak poprzednio ta emisja będzie dedykowana przede wszystkim do nich i to oni będą głównymi inwestorami.
W raporcie czytamy
Oferujący (DM BoŚ) DM BOŚ przystąpił do realizacji przyjętych w ramach umowy zadań, w szczególności do przeprowadzenia procesu badania popytu (book-building) wśród inwestorów instytucjonalnych, będącego podstawą do ustalenia ceny emisyjnej Akcji Oferowanych.
Zwracam dodatkowo uwagę, na sposób budowania akcjonariatu w emisjach Pure Biologocs– przede wszystkim na opiera się on na inwestorach instytucjonalnych, a oni chcą rynku głównego wraz ze wzrostem wartości spółki. W tym kontekście można z dużą dozą prawdopodobieństwa założyć, iż wyliczany oficjalny FF to oczywiście prawda ale jednocześnie całkowicie myląca , ponieważ poniżej 5% napchane jest już różnego rodzaju instytucjami, którzy budują swoją pozycję na lata a rzeczywisty FF jest minimalny. A to oznacza, ze kurs może być w miarę broniony (w razie problemów na rynku) , z drugiej strony jak cos się podzieje pozytywnego np.: pierwsza przedklinika, to drzwi wejściowe są bardzo wąskie, chętnych na zakup będzie sporo a sprzedający z oczywistych względów to jedynie rzeczywisty FF.
V. Podsumownie – Pure Biologics jest jedną z niewielu spółek w Polsce na poważnie realizującej programy badawcze w zakresie immunoonkologii. Ta dziedzina to przyszłość i w coraz większym stopniu teraźniejszość dzisiejszej onkologii, o tym mówią wszystkie autorytety medyczne i ta kwestia jest bezdyskusyjna. Spółka umiejscowiona jest w najbardziej atrakcyjnej części rynku biotechnologicznego : pracuje nad stworzeniem trzech leków „first in class” w zakresie immunoonkologii. Leki biologiczne osiągają najwyższe ceny transakcyjne na rynku, posiadają znacznie niższe ryzyka na etapie odkrywania oraz umożliwiają pozyskanie bardzo szybkiego partering już na etapie badań przeklinicznych. Pure Biologics ponadto realizuje trzy projekty rozwoju nowych terapeutycznych wyrobów medycznych (filtry biomolekularne) opartych na cząsteczkach aktywnych z grupy aptamerów.
Spółka znajduje się w ciekawym dla siebie momencie, bezpośrednio przed pierwszym badaniem przedklinicznym, dla cząstki PB001 MultiBody i kolejnymi czekającymi w kolejce. Jeżdżąc na wszelkie możliwe spotkania takich spółek, mam wrażenie, że rynek biotechnologii w Polsce mało kto rozumie, dotyczy to nawet zawodowców tj. inwestorów instytucjonalnych i ich analityków. Ja upatruję w tym jednak wielką szansę, zanim stanie się to modne podobnie jak gaming, wystarczy jeden mocny sukces polskiej firmy w tej dziedzinie.
Inwestowanie w biotechnologię jest trudne, w obecnym okresie szczególnie trudne. Wymaga wiedzy, czytania, wyciągania wniosków, szacowania ryzyka, ciągłego monitoringu. Odporności psychicznej na dużą fluktuację cen akcji. Ale tez potencjalna nagroda jest bardzo wysoka To inwestowanie nie dla każdego. Jeśli ktoś nie czuje się z tą pozycją komfortowo, to należy skorygować jej wielkość w portfelu lub w ogóle ją zlikwidować. Dla mnie spółka realizująca tematy za ponad 147 mln zł ( które w założeniu mają dać zysk razy X, można wpisać dowolną liczbę), o obecnej kapitalizacji ok. 180 mln zł nie ma w cenach kompletnie nic. Żadnego sukcesu. W moim przekonaniu - cokolwiek, potarzam cokolwiek, jakikolwiek partering, spowoduje wzrost do wartości krotnie wyższych od obecnych cen. To max rok. Jeśli taki okres jest nieakceptowalny dla inwestora, nie powinien inwestować. Podsumowując, w mojej opinii Pure Biologics to jedna z najciekawszych spółek na polskim rynku biotech a zważając zysk/ryzyka przy obecnej kapitalizacji, uważam, że najciekawsza
|
|
Temat:
PURE
Pure Biologics składa wniosek o zatwierdzenie prospektu emisyjnego do KNF-u. infostrefa.com/infostrefa/pl/w... Już kiedyś pisałem, że wielokrotnie wypowiadali się, że ich miejsce jest na głównym parkiecie, wiec przejście na GWP wraz z wejściem pierwszego projektu z Discovery do Przedkliniki to logika i konsekwencja. Zwróćcie dodatkowo uwagę, jak oni budują akcjonariat w emisjach – przede wszystkim na instytucjonalnych, a oni chcą rynku głównego wraz ze wzrostem wartości spółki i tyle. Ten wyliczany oficjalny FF to oczywiście prawda ale jednocześnie totalna ściema, ponieważ poniżej 5% napchane jest już różnego rodzaju instytucjami, którzy budują swoją pozycję na lata a rzeczywisty FF jest minimalny. A to oznacza, ze kurs może być w miarę broniony (w razie problemów na rynku) , z drugiej strony jak coś się podzieje pozytywnego np.: pierwsza przedklinika, to drzwi wejściowe są bardzo wąskie, chętnych na zakup będzie sporo a sprzedający z oczywistych względów to jedynie rzeczywisty FF. I na marginesie dla mnie jeden z tych mini sygnałów (ale ważnych) na które warto zwracać uwagę – oficjalnie zapowiadali pod koniec maja zamiar ubiegania się o przeniesienie notować na rynek główny, m-c później WZA to przegłosowało, m-c później (czyli teraz) prospekt gotowy a za 5-6 m-c będą z dużym prawdopodobieństwem na GWP. Tyle. Konsekwentnie robią swoje, bez wystrzałów, fajerwerków, idą tam gdzie chcą i oby im tak zostało.
|
|
Temat:
SCPFL
|
|
Temat:
PURE
14.08 raport za II kw i tam trzeba będzie szukać odpowiedzi co zostało zrobione, w opisach poszczególnych projektów. To biotechnologia , badania naukowe, typowa spółka na log z potencjalną, być może niesamowita nagrodą na końcu. Wrzuciłem sobie przed chwila kurs spółki na stooqu za ostatni rok, niecierpliwym też to proponuję - to zmienia sposób myślenia jak kursem może bujać. +20% ok, -20% tez ok, to tylko wahania cyfr nie mające nic wspólnego z wartością tej spółki
Przy okazji zapytałem Spółkę o ten częściowy zwrot zaliczki, oto odpowiedź
Szanowny Panie,
Dziękujemy za zainteresowanie naszą spółką i Pańską korespondencję. Zasady udzielania i rozliczanie zaliczek otrzymanych z NCBR są ściśle regulowane i podlegają rygorystycznym normom, których zobowiązani jesteśmy przestrzegać. Zaliczki udzielane są na okres maksymalnie 180 dniowy a ich wysokość zależy od całkowitej wartości etapu, który aktualnie jest realizowany. Etapy w naszych projektach trwają znacznie dłużej, stąd konieczność "śródetapowego" rozliczenia zaliczek. NCBR nie przewiduje instytucji "rolowania" zaliczek stąd konieczność technicznych operacji zwrotu i ponownego wystąpienia o wypłatę zaliczek.
z wyrazami szacunku,
Zespół Pure Biologics. S.A.
|
|
Temat:
PURE
Zarząd Pure Biologics S.A. (Spółka, Emitent) informuje, że po pozytywnym rozpatrzeniu przez Narodowe Centrum Badań i Rozwoju (NCBR) wniosku Spółki, Spółka otrzymała w dniu 19 czerwca 2020 r. jednorazową zaliczkę w kwocie 2 969 600 zł (dwa miliony dziewięćset sześćdziesiąt dziewięć tysięcy sześćset złotych) na realizację projektu B+R rozwoju leku PB004 (PureBike). Okres rozliczenia zaliczki wynosi 6 miesięcy. Uzyskane w ten sposób środki mają znaczący wpływ na wielkość zaangażowania kapitału własnego Spółki w bieżącą realizację projektów B+R i zdecydowanie pozytywnie wpłyną na płynność Emitenta w najbliższych okresach, poprzez przeniesienie ciężaru finansowania badań z modelu refundacyjnego na system zaliczkowy. Taki model finasowania jest zgodny z informacją zamieszczoną przez Spółkę w raporcie okresowym za 1. kwartał 2020 r. dotyczącą polityki optymalnego zarządzania płynnymi środkami finansowymi, ze szczególnym uwzględnieniem zaliczkowego modelu finansowania działalności badawczo-rozwojowej (B+R) przez instytucje dotujące. Powyższa informacja została uznana za spełniającą kryteria art. 7 ust. 1 MAR, ze względu na jej pozytywny wpływ na długoterminowe perspektywy rozwoju Emitenta. infostrefa.com/infostrefa/pl/w...
|
|
Temat:
SCPFL
To oznacza, że robią swoje i krok za krokiem realizując przyjęty harmonogram i zaliczając kolejne kamienie milowe, niezależnie od tego czy rynek dookoła wykazuje euforię czy głęboki sceptycyzm. Ten sposób działania jest bardzo skuteczny, ponieważ daje bardzo duże prawdopodobieństwo osiągnięcia sukcesu ale jest realizowany przez bardzo niewiele firm obecnych na rynku.
|
|
Temat:
SCPFL
Dobrze, że pokazałeś szerzej tych konkurentów, nie pomyślałem o tym. Na razie oczywiście rozmawiamy o bardzo młodej spółce (Scope), która jak na razie niczego nie sprzedała, ale patrząc na koszty działań innych podobnych profilowo spółek (jak piszesz dofinansowanie 30 mln USD na testy SARS-Cov2) , kapitalizacje takich spółek w USA (oczywiście jak im wyjdzie pomysł), bardzo młody i niedojrzały oraz bez spektakularnego sukcesu med-tech i biotech rynek polski, myślę sobie, że za 5, 10 lat możemy być w rzeczywistości, która na dzisiaj wydaje się nieracjonalna.
|
|
Temat:
PURE
Staram się na bieżąco analizować spółkę Pure Biologics, w tym zakresie opublikowałem już kilka swoich analiz. Ostatnio przeczytałem raport spółki za I kwartał 2020r. W wyniku tego zainteresowało mnie kilka zagadnień, w szczególności w odniesieniu do programów badawczych spółki, czyli tego co stanowi o jej podstawowej wartości. Poprosiłem spółkę o odpowiedź na kilka pytań i rozwinięcie kilku zagadnień. Spółka odpowiedział pozytywnie, moim rozmówcą był dr Przemysław Jurek Dyrektor DS Rozwoju biznesu spółki, którego sens wypowiedzi starałem się jak najlepiej oddać.
Pytanie : Na początek zaznaczę, że cofnąłem się z opisami postępów programów badawczych w kolejnych raportach kwartalnych oraz rocznych od I kw. 2019r do I kw. 2020 i jeśli mógłbym zasugerowałbym rozważenie podania szczegółowych zakresów etapów poszczególnych programów badawczych z szacowanym czasem ich wykonania. Z dotychczas opublikowanych, zakresy były podawane dla MultiBody i AptaPheresis,. Chodzi o inwestora, który chciałby weryfikować postęp prac w odniesieniu do początkowo przyjętych harmonogramów i założeń. Jest oczywiste, że mogą być zmiany i przesunięcia, to badania naukowe, jednak poznanie wstępnych założeń i ew. późniejsza ich korekta wydaje się pożądane.
Odp. Rzeczywiście plany tych dwóch programów zostały dokładnie rozpisane w Dokumencie Informacyjnym (2018), należy jednak pamiętać że mają one charakter szacunkowy i przyjęte zostały na wewnętrzne potrzeby monitorowania rozliczania postępów projektów . Przesunięcia miesiąc do trzech mieści w zakresie naturalnego błędu planowania działań badawczo-rozwojowych Trzeba pamiętać, że w spółce jest realizowanych 6 programów głównych i kilka pobocznych więc raportowanie technicznych przesunięć mogłoby być częste a nie wnosiłoby by nic istotnego z punktu widzenia oceny całego procesu badawczo rozwojowego. Techniczne odchylenia w realizacji etapów cząstkowych nie mają też charakteru informacji cenotwórczej, stąd też wszelkie informacje o postępach w realizacji prac badawczych prowadzonych w ramach projektów i ewentualnych korektach harmonogramów cząstkowych zamieszczane są w raportach okresowych . Spółka będzie nadal systematycznie komunikować swoje regularne postępy w badaniach raportach kwartalnych i na to inwestorzy powinni zwracać szczególna uwagę.
Pytanie : Najbardziej zaawansowany wasz projekt badawczy czyli PB001 Multibody - w I kw został złożony raport do NCBiR-u o zakończeniu etapu II. Pięć przeciwciał uzyskało odpowiednią specyficzność w odniesieniu do celów molekularnych, przeszło wstępne testy in vitro w tym testy cytotoksyczności oraz stabilności. Dlaczego więc dodatkowo trwają prace nad kolejnymi przeciwciałami ? Czy poprzez to, ze te kolejne przeciwciała są w trakcie prac nie cofamy się znowu do etapu II ? Uzyskanie pierwszych przeciwciał trwało dość długo, czy tyle samo będzie trwało uzyskanie kolejnych przeciwciał ? W III etapie należy przystąpić do rozbudowanych testów in vitro obejmujących badania, z wykorzystaniem komórek układu immunologicznego oraz komórek nowotworowych a po zakończeniu badań in vitro mają się odbyć pilotażowe badania na modelu zwierzęcym. Czy w tej sytuacji (tworzenie nowych przeciwciał) – termin przełomu roku jako przystąpienie do badań przedklinicznych na zwierzętach jest terminem realnym ?
Odp. To prawda, że 5 przeciwciał uzyskało odpowiednią specyficzność i cytotoksyczność, ale ponieważ pewien odsetek kandydatów odpada po drodze, cały czas generowani są nowi potencjalni kandydaci. To nie oznacza , że na dzisiaj otrzymanego kandydata trzeba czekać pół roku (jak to było z pierwszymi kandydatami). Spółka w procesie odkrywania ma bardzo dużo rzeczy opracowanych- białka kontrolne itp., i dużo prościej „wpiąć” je w pipeline. To są rzeczy równoległe i niezależne. Główne przeciwciała „idą” zgodnie z harmonogramem i nie czekają na te nowe. To minimalizowanie ryzyka. Cały czas utrzymywany jest planowany termin przełomu roku jako przystąpienie do badań przedklinicznych.
Pytanie : Drugi wasz projekt , który w planach ma wejść do przedkliniki pół roku po Multibody- PB003 Pureactivator – I etap był dwukrotnie przesuwany , raz do końca grudnia 2019r, drugi raz do 31 marca 2020. I i II etap planowane są na II kw 2020r, czy w sytuacji dwukrotnego przesunięcia etapu I jest to realne (tj. zakończenie II etapu do końca II kwartał)? Jak rozumiem Pureactivator jest przeciwciałem monospecyficznym z immunoligandem, dlaczego wiec mówi się o testowaniu raz z jednym celem molekularnym, a potem drugim, czy jedno przeciwciało monospecyficzne potrafi być specyficzne w odniesieniu do dwóch różnych celów molekularnych (pewnie nie, jak sama nazwa wskazuje) ? Czy w II etapie wyselekcjonowane przeciwciała będą testowane w zakresie stabilności i toksyczności i tego czy ligant aktywuje komórki N-k ?
Odp. Faktycznie były przesunięcia części I, lecz ta cześć jest zakończona i to zespół zdążył nadrobić. Są dwa różne białka które „operują” w tym samym szlaku komórkowym, póki co testowane są obydwa. To które będzie pokazywało lepszą skuteczność, tym się finalnie zespół będzie zajmować. Są to dwie bardzo podobne ale jednak równoległe ścieżki. Finalny kandydat będzie miał jeden cel molekularny, w pewnym momencie zespół musi się zdecydować na jeden z nich. Powinien być ten sam efekt jeśli chodzi o efekt biologiczny tj. dezaktywacji białka będącego celem molekularnym. Czas który upłynął niekoniecznie musi być nadrabiany w etapie II można to zrobić w III lub V. Drugi etap miał trwać w pierwotnym planie do końca czerwca br ale został skorygowany. Pomimo tego, cały harmonogram nie ulega zmianie ponieważ w założeniu któryś z późniejszych etapów ulegnie skorygowaniu.
Pytanie : PB002 Apthapheresist – czy planowane zakończenie etapu IV jest możliwe do końca II kw ? zgodnie z rozpisanym etapem (DI 2018r) "IV etap – opracowanie prototypu laboratoryjnego wyrobu medycznego (filtra aptamerowego) o potwierdzonej założonej skuteczności w modelu zwierzęcym, wdrożony i funkcjonujący w spółce system zarządzania ISO 13485, zaudytowany i gotowy do certyfikacji". Czy to znaczy, ze urządzenie po tym etapie idzie do certyfikacji ? co to znaczy „skuteczności w modelu zwierzęcym” ?
Odp. Te informacje pochodzą z dokumentu informacyjnego (2018r) z opisu jakie środki przeznaczone są na jaki etap. W rzeczywistości na część etapu IV i obecnie ten etap jest realizowany. Certyfikacja dotyczy systemu zarządzania ISO 13485, to jest system który dotyczy wyrobów medycznych a w tym przypadku chodzi o to, że to co spółka robi i dokumentacja, która powstaje była zgodna z tym systemem ISO. Aby składając dokumenty do regulatora, nie było wątpliwości, ze dokumentacja jest zrobiona zgodnie z wymaganym standardem. Natomiast sam wyrób medyczny docelowo ma być certyfikowany przez wykonawców. W projekcie jest badanie kliniczne i przygotowanie do certyfikacji ale bez samej certyfikacji. Certyfikację będzie robił ktoś kto ma już cała produkcję (odbiorca produktu). Wspomniany model zwierzęcy de facto oznacza przedklinkę. Trzeba zaznaczyć, że wyroby medyczne nie są tak uregulowane jak leki (w zakresie skuteczności i bezpieczeństwa). Tak naprawdę nie ma takiego wymogu, spółka wykonuje te działania w części dla siebie a w części dla potencjalnego odbiorcy, jako dowód rzeczywistego działania urządzenia.
Pytanie : na kilku forach inwestorskich pojawiło się oczekiwanie na koniec projekt MARA PB007 (projekt realizowany w konsorcjum), jak jest wartość tego projektu dla spółki ?
Odp. Projekt naukowo-technologiczny zakończony nawet z sukcesem nie nosi w sobie ani bezpośredniej wartości aplikacyjnej ani wartości komercyjnej. Te projekty naukowo-technologiczne nie są core business i nie można traktować jako coś cenotwórczego. Wartość takich projektów dla Spółki opisana jest w raporcie rocznych oraz w kwartalnych w których to spółka stara się to wyjaśniać.
Pytanie : W maju pokazał się raport o kolejnych zaliczkach na Pureactivator i aptaMG czy to znaczy , ze tak jakieś milestony zostały wykonane skoro pieniądze zostały przyznane a pewnie nie zostałby przyznane przez rozliczeniem tych grudniowych. Dlaczego nie było komunikatu w tej sprawie ?
Odp. Zaliczki udzielane są celowo i przypisane do realizacji konkretnych projektów B+R. o czym spółka informuje w kolejnych raportach bieżących, a zasady ich rozliczania określone są w aneksach do umów zawartych z NCBR . Pozytywne rozpatrzenie wniosku spółki o przyznanie zaliczki jest autonomiczną decyzją jednostki dotującej i wynika z jej wewnętrznych kryteriów oceny.
Pytanie - czy wszystkie etapy projektów jak niżej (wg. raportu I kw 2020) mają szansę się skończyć w terminie jak wskazano czyli II kw 2020r tj. kilka tygodni od dzisiaj ?
"Ze względu na rozszerzenie portfela realizowanych projektów B+R Spółki, środki pozyskane z emisji akcji serii D planuje się przeznaczyć na finansowanie realizacji:
• drugiego etapu projektu MultiBody o szacowanej wartości 6,1mln zł i z planowanym terminem realizacji II kw. 2020 roku,
• drugiego, trzeciego i części czwartego etapu projektu AptaPheresis o szacowanej wartości 3,9 mln zł i z planowanym terminem realizacji II kw. 2020 roku,
• pierwszego i części drugiego etapu projektu PureActivator o szacowanej wartości 5.4 mln zł i z planowanym terminem realizacji II kw. 2020 roku,
• części pierwszego etapu projektu PureBike o szacowanej wartości 3,2 mln zł z planowanym terminem realizacji II kw. 2020r
• pierwszego i części drugiego etapu projektu AptaMG o szacowanej wartości 2,7 mln zł i z planowanym terminem realizacji II kw. 2020 roku.
• trzeciego i ostatniego czwartego etapu projektu Pure Select2 o szacowanej wartości 1,6mln. zł i z planowanym terminem realizacji II kw.2020 roku,
• pierwszego etapu projektu AptaMNL o szacowanej wartości 0,6 mln zł z planowanym terminem realizacji II kw. 2020 roku"
Odp : Zgodnie z przyjętą polityką informacyjną Spółki ocenę realizacji postępów prac w prowadzonych projektach B+R za pierwsze półrocze 2020 przedstawi w raporcie okresowym w II kw 2020r.
|
|
Temat:
SCPFL
Wywiad , który ukazał się wczoraj z P.Garsteckim w i-micronews, a który przeprowadził Sébastien Clerc, Technology and Market Analyst, autor raportu Point-of-Need 2020 – Including PCR-Based Testing, Yole Développement. www.i-micronews.com/the-next-g...
|
|
Temat:
PURE
Nie przywiązuję zbyt dużej wagi do analizy technicznej w inwestowaniu, jeśli już interesuje mnie spojrzenie średnio i długoterminowe, jednak jeśli takie rzeczy widzę , które wczoraj się wydarzyły na Pure to muszę napisać. Wyjście dzienne z ponad rocznej konsolidacji na dużym obrocie. I oczywiście może być to wyjście fałszywe a świeca tygodniowa może zrobić wyłącznie cień i wrócić z powrotem do konsolidacji (podobnie jak pod koniec lutego), tego oczywiście nikt nie wie. Jednak tę formację warto obserwować, to pewne. 1drv.ms/u/s!AgWnaMROx3uepmACHu...Na te chwilę (2.06) 460 tys. obrotu i 80 pierwszych minut sesji, potwierdza ten ruch
|
|
Temat:
PURE
Plany przeniesienia notowań na parkiet główny wraz z emisją akcji. infostrefa.com/infostrefa/pl/w...Przyznam, ze początkowo byłem zaskoczony tą informacją, ale przeanalizowałem temat i teraz jest to dla mnie logiczne a ja po prostu o tym nie myślałem. Potrzebują finansowania na koniec roku to pewne (przy założeniu utrzymania zaliczkowania przez NCBir). Wielokrotnie wypowiadali się , ze ich miejsce jest na głównym parkiecie, wiec przejście na GWP wraz z wejściem pierwszego projektu z Discovery do Przedkliniki to logika i konsekwencja. Pytanie jest jak wyjdzie emisja, to będzie papierek lakmusowy dla spółki (ja na podstawie poprzednich udanych emisji oceniam, że nie będzie z tym problemu, ale to oczywiście do końca nie wiadomo). 6 m-cy od złożenia wniosku to czas konieczny, a wcześniej walne pod koniec czerwca, wiec czasowo się to zgrywa. Mogli oczywiście zrobić emisję pomostową pod koniec roku i wchodzić z dużą emisją w połowie 2021 kiedy będą wyniki przedkiliniki a kolejne będą się szykowały, z jakiś względów nie chcieli tego zrobić. Nie wiem dlaczego, jak bym miał zgadywać to mają chętne fundy tu i teraz i chcą z tego skorzystać.
|
|
Temat:
SCPFL
Nowe informacje jak niżej. To co się stało było przewidywalne i wysoce prawdopodobne : - o warunkowej rekomendacji projektu do uzyskania dofinansowania prac z związanych z rozwojem panelu PCR|ONE wykrywającego obecność wirusa SARS-CoV-2, w ramach konkursu Covid-19 prowadzonego przez Agencję Badań Medycznych. Uzyskanie grantu warunkowane jest odniesieniem się przez Curiosity Diagnostics sp. z o.o. do zmian rekomendowanych przez recenzentów, polegających na uszczegółowieniu pozycji w budżecie oraz korekty budżetu. Rekomendowana przez Agencję Badań Medycznych kwota dofinansowania wynosi ok. 2,6 mln zł. Ostateczna decyzja o finansowaniu podjęta zostanie przez Agencję Badań Medycznych do końca maja 2020 r. infostrefa.com/infostrefa/pl/w...- zakończenie realizacji działań w projekcie PCR|ONE przewidzianych w 6) etapie "Rejestracja i certyfikacja" może zostać wydłużone do 30 września 2020 r. - zakończenie realizacji działań w projekcie BacterOMIC przewidzianych w etapie 6a) "Przeprowadzenie serii testów prewalidacyjnych (...)" może zostać wydłużone i ukończone przed upływem III kwartału 2020 r. Możliwość wydłużenia realizacji ww. etapów wynika z ogólnej sytuacji wywołanej pandemią COVID-19, która m.in. ze względu liczne wprowadzone odgórnie ograniczenia wpływa na procesy wymagające współpracy z podmiotami zewnętrznymi. W odniesieniu do projektu PCR|ONE w głównej mierze oznacza to dłuższy czas potrzebny na przeprowadzenie oceny skuteczności klinicznej systemu PCR|ONE - panel MRSA/SA spowodowany utrudnieniami w gromadzeniu próbek przez szpitale. W odniesieniu do projektu BacterOMIC w głównej mierze oznacza to dłuższy czas potrzebny na przeprowadzenie serii testów prewalidacyjnych w zewnętrznych laboratoriach. Terminowość realizacji pozostałych działań harmonogramu projektu BacterOMIC, określonych w etapie 6b) i 6c), nie jest zagrożona. Tym samym zakończenie całości prac określonych w etapie 6) "Badania przedrejestracyjne", zostanie zakończona w IV kwartale 2020 r. tj. zgodnie z obowiązującym planem. infostrefa.com/infostrefa/pl/w...
|
|
Temat:
SCPFL
Gratulacje dla zespoł, oni naprawde to zrobili. W dwa m-ce od zabrania się do pracy stworzyli „proof of concept” działającego i wykrywający wirusa Sars cov-2 panelu. Test jest w pełni automatyczny (nie tak jak Abbott) i wykrywa wirusa w 15 min. Test został zaprojektowany dla wykrywania RNA, po raz pierwszy w historii Scope Fluidics wiec trzeba było zaprojektować szereg nowych etapów przygotowania próbki, bo było to coś całkowicie nowego. A pomimo to zrobili bez problemu i do tego bardzo szybko. Mówią, ze w przyszłości (na kolejne panele) będzie to jeszcze szybsze. Dla mnie to kolejny test prawdomówności Kamila Gewartowskiego (kierownika PCRone) i Piotra Garsteckiego, potwierdzenie tego co mówili o tym panelu zabierając się do jego realizacji i to że wiedzą co robią oraz kolejny raz dotrzymują słowa. To wielki atut rzadko spotykany na rynku.
|
|
Temat:
PURE
Zaktualizowane całościowe spojrzenie na spółkę po raporcie rocznym 2019r i konferencji spółki z dn. 25.04.2020r
W październiku 2019r ukazała się moja całościowa analiza spółki Pure Biologics. Minęło ponad pół roku, pokazały się kolejne raporty, doszły nowe informacje. Dlatego też zamiast wykonywać kolejny update do analizy, zmodyfikuję pierwotna analizę o wszystkie ważne nowe elementy , aby przekazać zainteresowanym całościową aktualną analizę spółki. Ponadto z najnowszych dokumentów źródłowych odsyłam do opublikowanego raportu rocznego za 2019r. Na stronie internetowej spółki zamieszczona jest ponadto ostatnia prezentacja inwestorska z konferencji 25.04.
Zaznaczam, nie przedstawiam wszystkiego od początku, ale same najważniejsze elementy biznesu spółki dla tych, którzy ją obserwują i się nią interesują. W którym miejscu są, co już zdołali zrobić, do czego dążą i jakie po drodze są ryzyka inwestycyjne. Zastrzegam, iż nie będę dotykał zbyt mocno opisu części usługowej ponieważ jej wartość, przy wartości części B+R jest dla mnie bez znaczenia. Zaznaczam też, nie mam przygotowania z biotechnologii, z góry wiec przepraszam za ew. przeinaczenia elementów naukowych, jeżeli takie nastąpią lecz idea jest inna- to tekst napisany przez inwestora dla inwestorów w celu lepszego zrozumienia specyfiki spółki, pracującej w bardzo trudnej dla laika branży jaką jest biotechnologia a co za tym idzie dokonania własnego podsumowania analitycznego.
W jakiej przestrzeni spółka pracuje czyli o co chodzi w tym biznesie
Pure Biologics jest jedną z niewielu spółek w Polsce na poważnie realizującej programy badawcze w zakresie immunoonkologii. Ta dziedzina to przyszłość i w coraz większym stopniu teraźniejszość dzisiejszej onkologii, o tym mówią wszystkie autorytety medyczne i ta kwestia jest bezdyskusyjna.
Spółka dysponuje nowoczesnym i dobrze wyposażonym laboratorium o powierzchni ok. 1000 m2, zlokalizowanym we Wrocławskim Parku Technologicznym, w którym zatrudnia 75 pracowników naukowych, a blisko 40% ze stopniem doktora (łącznie 86 specjalistów obsługujących segment naukowo badawczy). Ogółem zatrudnienie w spółce wynosi 101 osób (w przeliczeniu na pełen etat to 92 osoby wobec 60 na koniec 2018r).
Ja zapewniają przedstawiciele spółki, jej kompetencje pozwalają realizować wszystkie projekty rozwoju leków i terapeutycznych wyrobów medycznych od fazy wyboru celu molekularnego do fazy testów in vitro włącznie - w całości w oparciu o własne zasoby naukowe i technologiczne. Pozwala to na całkowitą niezależność od licencjonowania kandydatów na leki od innych podmiotów czy uczelni oraz usługowych firm zewnętrznych, możliwość kontroli i pełną poufność prowadzonych badań w ich początkowym, najbardziej wrażliwym momencie.
Spółka umiejscowiona jest w najbardziej atrakcyjnej części rynku biotechnologicznego : pracuje nad stworzeniem trzech leków „first in class” w zakresie immunoonkologii. Leki biologiczne osiągają najwyższe ceny transakcyjne na rynku, posiadają znacznie niższe ryzyka na etapie odkrywania oraz umożliwiają pozyskanie bardzo szybkiego partering już na etapie badań przeklinicznych. Pure Biologics ponadto realizuje dwa projekty rozwoju nowych terapeutycznych wyrobów medycznych (filtry biomolekularne) opartych na cząsteczkach aktywnych z grupy aptamerów.
Spółka posiada własne platformy technologiczne do generowania cząstek do programów badawczych PureSelect2 (platforma do generowania białek i przeciwciał) oraz PureApta (platforma do generowania tzw. aptamerów czyli sztucznie wygenerowanych łańcuchów DNA lub RNA przypominających przeciwciała).
Własne platformy
Jak podają przedstawiciele spółki , takich platform jest najwyżej kilkanaście na świecie. Pure Biologics na polskim rynku jest liderem technologii selekcji in vitro przeciwciał i aptamerów i jest także jednym z niewielu podmiotów komercyjnych zajmujących się tym zagadnieniem w Europie. Ale z praktycznego punktu widzenia inwestora, pomijając możliwość wykonywania dość unikalnych zleceń kontraktowych na własnych platformach, wynika jedna o wiele ważniejsza sprawa – spółka realizując programy badawcze zaczyna zawsze od generowania przeciwciał czy też aptamerów wykorzystując własną platformę. Jest to o wiele tańsze, prostsze i wielokrotnie lepsze rozwiązania od tych laboratoriów, których takich platform nie mają. Po pierwsze inne laboratoria muszą taką cząstkę zamówić – co zajmuje czas i kosztuje, po drugie jeśli okaże w trakcie badań, że zamówione cząstki nie posiadają pożądanych właściwości trzeba się z powrotem cofnąć i zamówić kolejne cząsteczki badawcze. To wszystko trwa i kosztuje, w Pure Biologics nie ma tego rodzaju problemu bo platformy są ich własnością i to jest wielka wartość dodana spółki. PureApta posiada patent w USA, w Europie jest w trakcie procesu rejestracyjnego, PureSelect2 jest w trakcie rozwoju , ale na bieżąco generuje cząstki na potrzeby spółki.
Otoczenie oraz obszary pracy spółki
Spółka pracuje w obszarze onkologii a raczej immunoonkologii w zakresie odkrywania leków biologicznych i programów aptamerowych a więc tam gdzie ceny transakcyjne są znacznie wyższe niż tradycyjnych leków chemicznych a światowa Big Pharma chcąc nie chcą podąża w tym kierunku. Dlaczego imunoonkologia jest tak atrakcyjna dla Big Pfarmy ? – otóż ze względu na większe bezpieczeństwo dla pacjenta (minimalizowanie skutków ubocznych w odniesieniu do leków konwencjonalnych), wykorzystanie naturalnych środków obronnych organizmu, o wiele szerszy zakres wskazań - leki tradycyjne potrafią mieć wyłącznie jedno wskazanie (czyli prościej chorobę, którą leczą) /lub max kilka, w imunoonkologii kilka/kilkanaście wskazań nie jest niczym dziwnym. Spółka może sprzedać licencję na cząsteczkę/ lub na określone wskazania a dalej powiększając pakiet wskazań dodatkowo monetyzować swoją pracę. Dlatego też obszar ten charakteryzuje się o wiele szybszą komercjalizacją (w lekach konwencjonalnych proces ten następuje zazwyczaj w czasie drugiego lub trzeciego etapu klinicznego) tutaj 50% cząstek w czasie badań posiada partnering w fazie przedklinicznej i aż 80% w czasie I fazy klinicznej. Wynika z tego, iż komercjalizacja w obszarze, w którym porusza się spółka następuje wiele lat wcześniej niż w lekach konwencjonalnych, co oczywiście jest o wiele atrakcyjniejsze zarówno do spółki jak i dla inwestorów.
Realizowane projekty
Spółka w chwili obecnej posiada 3 projekty lekowe oparte na przeciwciałach : PB001 Multibody (rak jelita grubego i odbytu), PB003 PureActivator (niedrobnokomórkowy rak płuc), PB004 PureBike (potrójnie negatywny rak piersi) oraz 3 projekty (w ty dwa terapeutyczne) oparte na aptamerach : PB002 AptaPheresis, PB005 Apta-MG, PB006 Apta-MLN.
Spółka celuje w obszar leków first in class, czyli krótko mówiąc leki w obszarze innowacyjnym, realizując/odkrywając nowatorskie podejście do mechanizmu działania cząstki leczniczej, który w określony sposób ma zadziałać (na tzw. cel molekularny) i zahamować daną chorobę. To tzw. MOA – mechanism of action, czyli mechanizm działania cząsteczki leczniczej na poziomie molekularnym, np. wiązanie określonego receptora białkowego. Dla inwestora jest ważne, że to najbardziej atrakcyjny kawałek tortu poszukiwania nowych leków, z najwyższymi cenami transakcyjnymi ponieważ wiele spółek pracuje w obszarze, gdzie MOA już jest określony i wytwarzają tylko kolejne przeciwciała o tej samej zasadzie działania. W tym drugim obszarze, jak mówią przestawicie spółki jest już gęsto (duża konkurencja i sporo kandydatów na leki), a jeśli jest gęsto to i ceny transakcyjne są rzecz jasna o wiele niższe.
Jak są rozwijane są poszczególne cząsteczki, na jakim są etapie – czyli kiedy możemy dojść do komercjalizacji ?
Multibody PB001 O co chodzi w tym leku ? celem jest tutaj zdjęcie hamulców blokujących limfocyty czyli komórki odgrywające bardzo ważną rolę w systemie odpornościowym człowieka, które zostały zablokowane przez nowotwór. Cząstki aktywne stworzone przez spółkę mają zawsze dwa cele – w tym przypadku zdjęcie hamulców blokujących limfocyty (czyli MOA) , drugim celem dla każdej odkrywanej cząstki jest zawsze bezpieczeństwo. W tym projekcie badawczym jak twierdzą przedstawicie spółki, w laboratorium cele nr 1 i 2 są potwierdzone, nie tylko na komórkach ludzkich ale tez mysich i małpich – to ważne bo badania przedkliniczne na zwierzęta są wtedy o wiele tańsze i prostsze i nie trzeba specjalnie modyfikowanych myszy z komórkami ludzkimi. Spółka przygotuje się do rozpoczęcia na przełomie 2020/2021 badań przedklinicznych, czyli tego etapu gdzie można by rozpocząć komercjalizować projekt. Kiedy pierwsza transakcja parteringowa? Ja zapewniają przedstawicie spółki projekt Multibody PB001 będą chcieli skomercjalizować we wczesnych fazach przedklinicznych, bo będzie to walidator dla spółki. Nawet jeśli kwota miała by być mniejsza to zaistnienie na rynku parteringowym, jako spółka, która już cos sprzedała, na pewno pozwoli już mieć inną pozycję negocjacyjną w późniejszych transakcjach oraz dostarczy kapitału.
Mniej zaawansowany jest projekt PB003 PureActivator, a jeszcze mniej PB004 PureBike . Wg. oświadczeń spółki ich ideą jest wprowadzeniu do badań przedlinicznch projekt PB003 Pureactivator pół roku po Multibody PB001 a następnie po kolejnym pół roku PB004 PureBike. Czyli przesunięcie pomiędzy tymi projektami wynosi pół roku. To ważna informacja ponieważ pozwala inwestorowi ustalić możliwość potencjalnej komercjalizacji na osi czasu a co za tym idzie oszacować możliwości zwiększanie się kapitalizacji spółki, oczywiście w przypadku pozytywnego scenariusza.
Nie będę tutaj opisywał dokładnego mechanizmu działania cząstek w poszczególnych projektach, ponieważ z inwestorskiego punktu widzenia, niewiele to wnosi, dość wiedzieć, że każda z tych rozwijanych cząstek realizując oczywiście first in class reprezentuje zupełnie inne podejście naukowe co jest wartością dodaną dla potencjalnych zainteresowanych firm farmaceutycznych. Na rynku zdarzają się takie transakcje by Big Pharma kupowała daną cząsteczkę jednocześnie „rezerwując” prawo pierwokupu kilku innych, które były w badaniach właśnie poprzez unikalność i różnorodność podejść badawczych. Niestety, nie czuję się kompetentny do oceny tego elementu, więc informację tę podaję tylko dla porządku.
Chciałbym tutaj podkreślić jeszcze jeden ważny (a raczej prawdopodobnie najważniejszy) cenotwórczy aspekt. To rozwijane leki białkowe są główną wartością spółki i od stopnia ich rozwoju (a w konsekwencji możliwości komercjalizacji) w rzeczywistości zależy kapitalizacja spółki. Dlatego też inwestor, który na poważnie chce się zainteresować spółką powinien zaczynać raporty kwartalne właśnie od opisu rozwoju tych cząstek/porównując do opisu kwartału poprzedniego. Dokładna analiza tego elementu wraz z umiejscowieniem go we wcześniej podanym harmonogramie poszczególnych etapów odpowie w którym miejscu spółka jest na drodze do komercjalizacji. Zastrzeżenie jest takie, że to są badania naukowe a więc kilka miesięcy przesunięcia to nic dziwnego, oczywiście warto zawsze przeczytać wyjaśnienia, z czego takie ew. przesunięcia wyniknęły. Ten akapit, to moim zdaniem jedna z najważniejszych podpowiedzi inwestorskich w tej analizie.
Aptamery – jak podano powyżej pipeline spółki, w tym zakresie, stanowią : PB002 AptaPheresis (wskazanie zespół Devica) , PB005 Apta-MG (wskazanie miastenia rzekomoporaźna), PB006 Apta-MNL (wskazanie czerniak).
W dwóch pierwszych projektach spółka wykorzystuje aptamery w urządzeniach medycznych. Są to działania celowe, ponieważ, jak mówią specjaliści, choć aptamery to przyszłość (są m.in. o wiele bardziej stabilne niż białka i ich produkcja jest przez to prostsza i bardziej powtarzalna) to lek oparty na aptamerach na świecie jest zaledwie jeden, kilkanaście jest w badaniach klinicznych. Spółka pragnąc powiększać swoją kompetencje w tym zakresie realizuje na razie urządzenia medyczne oparte na aptamerach, a jednocześnie obserwując rynek rozwijany w tym obszarze. Podobnie jak w zakresie cząstek białkowych Multibody, tutaj najbardziej zaawansowany projekt to ApthaPheresis PB002.
O co chodzi w ty projekcie ?– u chorych na tę rzadką chorobę-zespół Devica- obecnie stosuje się tzw. plazmaferezę tzn. przetacza się krew chorego usuwając szkodliwe (uszkodzone) białka. Niestety metoda ta ma mnóstwo skutków ubocznych bo razem z uszkodzonym białkiem oczyszcza osocze z wszystkiego co człowiek potrzebuje do życia. A aptamer Pure Biologics w specjalnym urządzeniu usuwa wyłącznie białko odpowiedzialne za chorobę bez czegokolwiek innego. Wg. spółki jednoznacznie model działa. Tym samym w ramach projektu PB002 AptaPheresis Spółka w roku 2019 osiągnęła zamierzone cele badawcze. Spółka prowadzi prace doświadczalne nad pierwszym laboratoryjnym prototypem biofiltra zawierającym wyselekcjonowane już specyficzne do przeciwciał anty-AQP4 aptamery, który zostanie wykorzystany w dalszych badaniach. Rozpoczęcie badań przedklinicznych planowane jest na przełom roku 2020/2021.
PB005 i PB006 – projekty są na o wiele wcześniejszym etapie.
Najbliższe milestony wielu programów kończą się w II kw br. a wiec w przeciągu najbliższych dwóch miesięcy czeka nas wysyp komunikatów , który prawdopodobnie nie zostanie bez wpływu na kurs spółki
Środki pozyskane z emisji akcji serii D planowane były na finansowanie realizacji:
- drugiego etapu projektu MultiBody o szacowanej wartości 6,1mln zł i z planowanym terminem realizacji II kw. 2020 roku,
- drugiego, trzeciego i części czwartego etapu projektu AptaPheresis o szacowanej wartości 3,9 mln zł i z planowanym terminem realizacji II kw. 2020 roku,
- pierwszego i części drugiego etapu projektu PureActivator o szacowanej wartości 5.4 mln zł i z planowanym terminem realizacji II kw. 2020 roku,
- części pierwszego etapu projektu PureBike o szacowanej wartości 3,2 mln zł z planowanym terminem realizacji II kw. 2020r
- pierwszego i części drugiego etapu projektu AptaMG o szacowanej wartości 2,7 mln zł i z planowanym terminem realizacji II kw. 2020 roku.
- trzeciego i ostatniego czwartego etapu projektu Pure Select2 o szacowanej wartości 1,6mln. zł i z planowanym terminem realizacji II kw.2020 roku,
- pierwszego etapu projektu AptaMNL o szacowanej wartości 0,6 mln zł z planowanym terminem realizacji II kw. 2020 roku
Umowy w obszarze immuonoonkologii realizowane z Big Pharmą na świecie
Spółka pokazuje statystyki liczby umów w zakresie immunoonkologii (partering +M&A) – ten rynek rośnie z roku /rok, od 300 umów w 2012r po ok. 700 umów w 2018r
Najbardziej cenne transakcje w zakresie nowych leków są to leki biologiczne. W „top 10” najwyższych transakcji leki biologiczne stanowiły w 2018r 7/10 to w 2019r już jest 8/2019.
Płatności Upfront – wielkości również rosną z roku/rok jednak jest to obraz zakłócony przez kilka większych transakcji, bardziej prawdziwym jest stwierdzeniem, iż mediana umów miała takie płatności w zakresie 30-40 mln USD.
Kiedy Big Pharma wchodzi w projekty ? jak wspomniano już powyżej - 50% projektów posiada partering w fazach przedklinicznej, 80% w I klinicznej. A wiec jest to bardzo dużo i stanowi zupełnie inne reguły gry niż w przypadku leków tradycyjnych.
Transakcje referencyjne
Na spotkaniach spółka pokazuje wybrane transakcje referencyjne. Jak zapewnia spółka transakcje te są precyzyjnie dobrane pod względem podobieństwa i dotyczą bardzo podobnych obszarów terapeutycznych ( immunoonkologia) oraz cząstek aktywnych leku jak rozwijane przez nich (np.: przeciwciała bispecyficzne jako cząstki aktywne leku w kategorii First- in –class). Podane wartości to od 15 mln eur (transakcja na początku fazy przedklinicznej) do 120 mln USD ( transakcja przed pierwszą fazą kliniczną) jako Up-front + 0,6 do 1,7 mld Milestones + Royalties /jedną cząsteczkę.
Przyznaję, że wartości są prawie niewiarygodne w odniesieniu do obecnej kapitalizacji spółki. Można oczywiście, na tej podstawie, pokusić się o policzenie wartości spółki posiłkując się prawdopodobieństwem dojścia do poszczególnych faz i wartością pieniądza w czasie. Ja tego robić nie będę. Należy przy tym przypomnieć, że wszystkie realizowane projekty są zaplanowane do zakończenia pierwszej fazy klinicznej i mają do tej fazy zapewnione dofinansowanie z NCBR.
Pomimo iż Spółka nie deklaruje jeszcze konkretnie kiedy będzie komercjalizować– czy na bardzo wczesnym etapie fazy przedklinicznej czy poczekać za większą premią związaną oczywiście z rozwojem projektu. Jednak, jak podano powyżej, z ostatnich wypowiedzi przedstawicieli spółki wynika, że Projekt Multibody PB001 będą chcieli skomercjalizować we wczesnych fazach przedklinicznych, bo będzie to walidator dla spółki. Nawet jeśli kwota miała by być mniejsza to zaistnienie na rynku parteringowym, jako spółka, która już cos sprzedała, na pewno pozwoli już mieć inną pozycję negocjacyjną w późniejszych transakcjach oraz dostarczy kapitału.
Organizacja spółki
Pure Biologics skończył w 2019r całkowite kompletowanie zespołu oraz jego docelową organizację. Realizacja projektów B+R w Spółce opiera się na współpracy Zespołów Naukowych i Grup Badawczych z Naukowymi Kierownikami Projektów. Wg. spółki , przyjęcie takiego rozwiązania pozwala na optymalne wykorzystanie zasobów naukowych, koncentracji wiedzy i doświadczenia Ekspertów w zakresie badań, w których posiadają kluczowe kompetencje.
6 wysokospecjalizowanych grup badawczych m.in. Zespoły Aptamerowy, Inżynierii Białka, Przeciwciał, Biologii Molekularnej itd. , Biuro zarządzania Projektami, Zespół naukowych menadżerów projektu
Nowe działy to: HR –z doświadczeniem współpracy z naukowcami, Dział scoutingowy i doradczy, który obserwuje transakcje referencyjne + inne aktualności rynku
Oraz bardzo ważne nowe zespoły – z ludźmi, którzy przygotowują badania przedkliniczne z doświadczeniem międzynarodowym.
Pieniądze na badania i przyszłe emisje
Wszystkie projekty komercyjne będą realizowane do końca 2023r (jeden do połowy 2023). Katalog projektów na dzisiaj jest zamknięty. Całkowita wartość projektów to 147 mln w tym dotacje 109,7, wkład własny 37,3 mln, częściowo już pozyskany oraz konieczny do pozyskania od inwestorów.
Ostatnia emisja spółki była w kwietniu 2019r i miała w założeniu starczyć na rok, półtora ale kiedy przyszły kolejne projekty badawcze to wydatki wzrosły ok. x 1,5 (50% w stosunku do wartości projektów przy emisji). Nowe projekty były planowane do realizacji z dużym wyprzedzeniem, a na uzyskanie dofinansowania zakładano proceduralnie dłuższy okres , udało się je pozyskać w krótkim czasie już w 2019r. Powstał oczywiście temat finansowania i przyszłej emisji ale spółka przeszła na okresowy zaliczkowy system rozliczania projektów B+R . NCBR przyznał jednorazowe zaliczki, w łącznej kwocie 9,5 mln zł, na realizację projektów badawczo-rozwojowych: PB001 MultiBody, PB002 AptaPheresis, PB003 PureActivator, PB005 Apta-MG, PB010 PureSelect2. Na koncie spółki było na koniec 2019r 13,93 mln zł.
Ile spółka chce planuje wydać w 2020r –
Z ostatniej prezentacji wynika, że zaawansowanie wszystkich projektów w 2020r zwiększy się z 12,3 % do 30,7% czyli jak łatwo policzyć zostanie wydane 27 mln (z 147) z tego wkład własny 6,86 mln (z 37,3). W tym Pb001- 5,25 mln, Pb003-6,62 mln, Pb004 purebike- 6,38 mln, Pb002- 3,39 mln
Wyraźnie widać, ze programy lekowe pochłoną najwięcej pieniędzy i to jest podstawowa wartość, bo to one budują wartość dla spółki.
Czyli kiedy ta emisja ? to wszystko zależy od tego czy NCBiR utrzyma system zaliczkowania, jeśli utrzyma - przyszła emisja pewnie pojawi się koniec 2020, początek 2021r. Jeśli NCBiR nie utrzyma systemu zaliczkowania i wróci do rozliczania zakończonych etapów, taki komunika ze strony spółki będzie oznaczał ,iż zaczynają się szykować do emisji. Z kontekstu ostatniego spotkania ze spółką wynikało, iż mają nadzieje, ze ten system zostanie podtrzymany i będą mogli prowadzić finansować z zaliczek, ale oczywiście nie ma jeszcze podpisanych umów i to nie jest „twarda” informacja.
Program motywacyjny
Spółka traktuje pracowników jako swój największy kapitał. I trudno się z tym nie zgodzić, bo to oni są decydującym ogniwem czy ma szansę na sukces czy też nie.
W październiku nastąpiła deklaracja oddania własnych akcji przez Akcjonariuszy Założycieli celem realizacji Programu motywacyjnego. Jak deklaruje spółka , celem programu motywacyjnego jest pozyskanie i motywowanie wyżej wymienionych osób wnoszących swoje doświadczenie, wiedzę i aktywność zawodową, przekładające się na osiągnięcia w realizacji innowacyjnych projektów badawczo-rozwojowych, wartość oraz pozycję rynkową spółki
Jak łatwo policzyć dotyczy to aż 14,6% kapitalizacji spółki i ok. 26% akcji posiadanych przez Akcjonariuszy Założycieli. W tym celu uprzywilejowane akcje imienne serii A (posiadające dwa głosy na jedną akcję) zostały zamienione na akcje zwykłe na okaziciela. Nie pamiętam zachowania jakiekolwiek spółki na giełdzie w ten sposób w takim zakresie.
Żeby niepotrzebnie się nie rozwadniać, krótko : dla mnie taka postawa to objaw szacunku dla akcjonariuszy i potwierdzenie świadomości tego co stanowi największą wartość tego rodzaju spółki – ludzie i to najlepsi, trzeba ich przyciągać lub jeśli są zatrzymać i zmotywować. Wtedy spółka będzie miała prawdopodobieństwo uzyskania jak najlepszych wyników prac oraz uzyskania oczekiwanego wyniku, wycena eksploduje i wszyscy zarobią. To myślenie strategiczne i długofalowe niedostępne dla zarządów większości spółek giełdowych a tu urealnione i zrealizowane. Program motywacyjny będzie realizowany do końca 2021r, na akcje będą podpisane umowy lock-up.
Ryzyka
Czy są? – oczywiście, że tak, to spółka, która do tej pory jeszcze nie miała komercjalizacji, obszar biotechnologii oraz programy badawcze dlatego ryzyka oczywiście istnieją. Najważniejsze ryzyka to : posypanie się badań, brak finansowania lub odejście kluczowych osób. Ale trzeba też pamiętać, że ryzyka te są zarządzane i ograniczane – spółka posiada 6 programów badawczych dofinansowanych w 75% przez NCBiR Pierwszy program lekowy oraz program aptamerowy będą wchodziły w fazę przedkliniczną na przełomie 2020/2020, po nich będą wchodziły kolejne dwa programy lekowe w odstępach półrocznych. Faza przedkliniczna jest ta fazą, która dla leków biologicznych z immunoonkologii jest charakterystyczna do zawierania umów parteringowych. Dodatkowo jest duży program motywacyjny, którym objęci są wszyscy pracownicy spółki.
Z dodatkowych ryzyk trzeba pamiętać, że spółka jest na NewConnect co oznacza bardzo niska płynność, możliwe bardzo duże wahania zmiany wartości akcji w szczególności przy określonych komunikatach – zarówno pozytywnych jak i negatywnych. Pamiętajmy jednak o sygnałach spółki przygotowywania się do spełnienia standardów wymaganych na GPW, co jest zupełnie zrozumiałe przy określonej wielkości spółki i przy korzyściach polegających min. z możliwości inwestowania określonych funduszy mających ograniczenie statutowe wyłącznie na spółki z GWP.
Czy przeciętny inwestor może oceniać spółkę biotechnologiczną
Pure Biologics to spółka z zakresu biotechnologii czyli dziedziny postrzegalnej przez inwestorów jako dziedzina wysokiego ryzyka. Oczywiście co do zasady statystycznej jest to dobre założenie. Jednak ja staram się specjalizować w takich spółkach i uważam, że to właśnie one za kilka lat staną się hitem polskiego rynku w tym oczywiście m.in branża biotechnologiczna. Inwestorzy zagraniczni, którzy teraz inwestują w polskie nieruchomości lub kapitałem VC wchodzą w młode spółki niepubliczne wcześniej czy później wykorzystają dysproporcję pomiędzy swoim rynkiem a rynkiem polskim jak robili to w innych obszarach inwestycyjnych. Jak mówi Paweł Przewięźlikowski twórca Selvity - za nimi stoi 40 lat doświadczeń inwestowania w branże biotechnologiczną (np.: rynek amerykański) , nauczyli się jej, za polskimi inwestorami tylko kilka lat. To, ze tak się stanie , w moim przekonaniu jest wysoce prawdopodobne.
I tu pojawia problem, mocno dyskutowany przez inwestorów - kto może ocenić sens działań spółki zajmującej się biotechnologią : student medycyny lub biotechnologii - wątpię, absolwent tych kierunków- również głęboko wątpię. Projekty na dziesiątki mln przechodzą przez NCBiR gdzie analizowane są przez zespoły kompetentnych naukowców. Spółka taka jak Pure Biologics mając w swoim składzie kilkudziesięciu dr biotechnologii i nauk pokrewnych, z całego świata, pokazywała by tematy, bez naukowego lub komercyjnego sensu wystawiając się na śmieszność i podważając swój autorytet - oceniam to jako nieprawdopodobne. Tu moim zdaniem rzecz idzie czy mają szansę doprowadzić projekty do komercjalizacji – a to można monitorować analizowaniem działań spółki zarówno tych naukowych jak i biznesowych. Trzeba mieć w tym zakresie kompetencje to jasne , ale jak wszystko na tym świecie można je zdobyć, jest tylko kwestia poświęconego na to czasu.
Podsumowanie
Pure Biologics to spółka biotechnologiczna, której kompetencje pozwalają realizować wszystkie projekty rozwoju leków i terapeutycznych wyrobów medycznych od fazy wyboru celu molekularnego do fazy testów in vitro włącznie - w całości w oparciu o własne zasoby naukowe i technologiczne. Spółka umiejscowiona jest w najbardziej atrakcyjnej części rynku biotechnologicznego : pracuje nad stworzeniem leków „ first in class” w zakresie immunoonkologii. Są to leki biologiczne osiągające najwyższe ceny na rynku, posiadające znacznie niższe ryzyka oraz umożliwiające pozyskanie bardzo szybkiego partering już na etapie badań przeklinicznych. Ryzyka oczywiście są ale trzeba też pamiętać, że ryzyka te są zarządzane i ograniczane – spółka posiada 6 programów badawczych dofinansowanych w 75% przez NCBiR dodatkowo przemyślana organizacja spółki, duży program motywacyjny, kompetentny międzynarodowy team.
Inwestowanie w biotechnologię jest trudne, w obecnym okresie szczególnie trudne. Wymaga wiedzy, czytania, wyciągania wniosków, szacowania ryzyka, ciągłego monitoringu. Odporności psychicznej na dużą fluktuację cen akcji. Ale tez potencjalna nagroda jest bardzo wysoka To inwestowanie nie dla każdego. Jeśli ktoś nie czuje się z tą pozycją komfortowo, to należy skorygować jej wielkość w portfelu lub w ogóle ją zlikwidować. Dla mnie spółka realizująca tematy za ponad 140 mln zł, o obecnej kapitalizacji ok. 80 mln zł nie ma w cenach kompletnie nic. Żadnego sukcesu. W moim przekonaniu - cokolwiek, potarzam cokolwiek, jakikolwiek partering, spowoduje wzrost do wartości krotnie wyższych od obecnych cen. To rok, max półtorej. Jeśli taki okres jest nieakceptowalny dla inwestora, nie powinien inwestować. Podsumowując, w mojej opinii Pure Biologics to jedna z najciekawszych spółek na polskim rynku biotech a zważając zysk/ryzyka przy obecnej kapitalizacji, uważam, że najciekawsza
|
|
Temat:
SCPFL
Wczoraj pojawiła się informacja, która ukazuje, iż wyliczenia rynku w raporcie Yole Developpement dla zwiększania się rynku dla diagnostyki mmolekularnej z 4,1 mld UDS w 2019r do 10,1 mld USD w 2025r są już nieaktualne.
Senat USA przegłosował wart 484 mld dolarów (2.3% PKB) kolejny pakiet pomocy fiskalnej, nad którym w czwartek głosować będzie Izba Reprezentantów. Szpitale oraz podmioty służby zdrowia uprawnione będą w ramach pakietu do ubiegania się o zwrot kosztów związanych z walką z pandemią koronawirusa. Plan ten jest wyceniany na 75 mld dolarów (0.4% PKB), natomiast finansowanie zwiększonej liczby testów na 25 mld (0.1% PKB).
Oczywiście nie wszystkie testy będą testami molekularnymi (nawet większość nie będzie) ale pokazuje to bezprzecznie kierunek w którym zmierza świat i co za tym idzie potencjalne zainteresowanie systematami diagnostyki oraz ich twórcami.
Czy Scope Fluidics to wykorzysta, czy też nie to już zupełnie odrębny temat, ale to, ze klimat dla negocjacji tego rodzaju urządzeń jak PCRone jest więcej niż dobry to chyba zupełnie jasne.
|
|
Temat:
SCPFL
Moim zdaniem musi to nastąpić pomiędzy lipcem a listopadem (max grudniem), kiedy już będzie certyfikowany i zarejestrowany PCRone. To moja najlepsza wiedza na ten moment.
|
|
Temat:
SCPFL
Sporo pisałem o metodyce oceniania swojego prawdopodobieństwo jakiegoś elementu dla danej spółki, wiec nie będę się powtarzał, z drugiej strony bardzo cyfr nie lubię publicznie podawać bo można się przestrzelić (a raczej bardzo prawdopodobne , ze tak się stanie). Ale jeśli już muszę …… moim zdaniem prawdopodobieństwo certyfikacji i rejestracji PCRone wynosi min. 80%. Tu mamy ryzyko, ze może nastąpić nie do końca czerwca lecz np.: m-c, dwa później jeśli np.: szpital kliniczny będzie miał ograniczenia (jakie i jak długo trwające?) pracy zleceń zewnętrznych ze względu na koronowirusa, tego się prze przeskoczy. Jednak widząc działania naszych (i całej UE) politycznych geniuszy, którzy powoli dochodzą oni do odkrywczego wniosku, że za chwilę funkcjonowania państw się załamią, jeśli blokady będą dalej trwały i podatków nie będzie kto płacić jestem raczej dobrej myśli.
Kolejny element to sprzedaż to tutaj sytuacja się komplikuje, im dłużej zwlekają tym większe ryzyko konkurencji, która może szybkiej sfinalizować transakcję i wpłynąć na cenę ich produktu. Z drugiej strony im więcej dodatkowych działań (na które została przeznaczona ostatnia emisja) wykonają tym większą cenę transakcyjną osiągną - tutaj jest dylemat równowagi pomiędzy tymi dwoma elementami. Aby skomplikować sytuację wchodzi nam dodatkowy puzzel do układanki – test na koronowirusa a raczej panel wirusowy , na którym będzie właśnie możliwa dodatkowa diagnostyka Sars covid-2. Jeśli dostaną dofinansowanie z UE (a oceniam to bardzo wysoko) to mogą temat doprowadzić do końca (certyfikacja, rejestracja) a nie tylko do testów wewnętrznych na które pieniądze mają już teraz. To oczywiście kosztuje czas , jaki ja tego nie wiem. Jednocześnie wiem, że oni wiedzą, że powinni transakcję zrobić bardzo szybko, to rynek w nich uwierzy i zyskają wiarygodność nie jako startup a jako podmiot , który pierwszy na polskim rynku sprzedał cos takiego w dobrych pieniądzach.
Może to wszystko przydługie, ale uwarunkowań jest mnóstwo i nie ma jednej, jedynie słusznej odpowiedzi.
Cena transakcyjna – jeśli już muszę… na jesień, po rozmowach po walnym, wnioskuję, że dyskutowali z potencjalnymi kupcami o cenach 80-130 mln usd. Teraz sytuacja jest zupełnie inna , szybka diagnostyka stanie się nr 1 obok szczepionki i cały świat na to stawia. Więc ostrożnie oceniam cenę możliwa do osiągnięcia jako cenę z jesieni x liczba naturalna (bez zera :)) od 2-3. Analiza oczywiście obarczona ryzykiem błędu.
|
|
Temat:
SCPFL
Ukazał się raport niezależnej firmy doradczej Yole Developpement http://www.yole.fr/index.aspx“Point-of-Need Testing: Application of Microfluidic Technologies 2020”. www.i-micronews.com/products/p... Raport dla “one users licence” kosztuje 5990 EUR, więc wybaczcie napiszę tylko to co wiadomo z ogólnie dostępnych fragmentów. Każdy może je sam pobrać i dokładnie przeczytać bezpośrednio ze strony. Raport dotyczy obecnych możliwości wykrywania wirusa SARS Cov-2 wywołującego chorobę Covid-19. Szczegółowo opisuje on 50 podmiotów na rynku uwzględniając możliwe przez nich wykonywane różnego rodzaju testy obejmujące immunologię, diagnostykę molekularną, chemię kliniczną i inne. Ponadto raport prognozuje jak będzie przedstawiał się ten rynek do 2025r. Jedyna polską firmą, którą potrafiłem dostrzec, umieszczoną w raporcie jest Scope Fluidics. Jak wynika z raportu diagnostyka molekularna to jedyny kierunek, w którym będzie zmierzał świat – prognozowany jest wzrost udziału tego fragmentu w rynku z ponad 50% w 2019r do 75% w 2025r. Rynek testów diagnostyki molekularnej opartych na mikrofluidice wzrośnie z 4,1 mld UDS w 2019r do 10,1 mld USD w 2025r. Wykres (zamieszczony w ulotce promującej raport) pokazuje głównych graczy na rynku , w tym PCRone Scope Fluidics. Bardzo ciekawa jest wskazana w raporcie tendencja - dzisiejszy wyścig zmierza do zmniejszenia czasu analiz do min. 20 min. jednocześnie powiększając multipleksowość tj. równoległe wykrywanie kilku patogenów. W wykresie zatytułowanym „ Market trends” na str. 19 (próbka raportu) „Rapid, high-multiplex molecular testing ” najbardziej pożądanym obszarem jest Market-empty zone: upcoming players will try to fill it. są wymienione trzy podmioty w tym PCRone Scope Fluidics. Zapraszam do lektury tego profesjonalnego raportu z wszystkimi największymi graczami na rynku.
|
|
Temat:
SCPFL
Pozwólcie, że napiszę kilka zdań na temat inwestowania w spółki innowacyjne (tutaj w Scope Fluidics). Sam staram się specjalizować w takich spółkach, ponieważ wiem, że takie inwestycje mogą przynieść ponadprzeciętne zysk. Dlatego też, na własne potrzeby stworzyłem strategię, która jest może prosta ale dla mnie okazuje się bardzo skuteczna. Pierwszym jej elementem jest bardzo dokładna analiza ryzyka, precyzyjny researach działań spółki- co obiecała, co zrobiła, jaka jej historia, dotrzymywanie terminów, kamieni milowych itp. Drugim elementem jest analiza ludzi- doświadczenia, kompetencji, dotychczasowej publicznej prawdomówności - oni decydują o tym co się uda w spółce a co nie. Trzecim elementem jest jak najszerszy monitoring bieżący, kontakt ze spółką (wykorzystywanie w tym zakresie każdej okazji), bezpośrednie rozmowy, obserwowanie postępów/lub brak prac. Czytanie tekstów komunikatów, wypowiedzi, raportów po kilka raz - wyłapywanie najmniejszych niuansów. Po co to wszystko ? - oczywiście po to aby na początku ocenić możliwości wykonania danego tematu oraz ryzyka z nimi związane a potem systematycznie to monitorować i weryfikować. To ciężka praca, męcząca, monotonna, zabierająca setki godzin ale wiem, ze im lepiej będzie wykonana tym bardziej moja analiza jest bardziej prawidłowa a i ryzyka dokładniej określone. Oczywiście jak najchętniej szukam informacji o konkurencji, czytam inne spojrzenia oraz zdania innych osób, informacje , które inni posiadają ponieważ to wchodzi z zakres określenia ryzyk które kontroluję.
Jednak niedopuszczalnym w mojej strategii jest opieranie się na emocjach , brak zaufania do spółki ze względu na historie inny podmiotów na rynku- cormaya, mabion czy cokolwiek innego. To element emocjonalny a nie logiczny. To element, który przesłania racjonalną analizę , wiec muszę go z głowy wyłączyć i opierać się wyłączenie na tym co sam zrobiłem. Nie może on rzutować na moim inwestowaniu, bo co ma wspólnego historia podmiotów, które którym się nie udało, lub które po prostu oszukały z konkretną spółką która się w danej chwili zajmuję- dokładnie nic. To czy im się uda czy nie ustalam sam na podstawie opisanej powyżej strategii którą systematycznie realizuję, a nie na tym jaki przygody miały inne spółki. Dlatego dopóki Scope będzie dotrzymywał terminów, dopóki nie stanie się coś co podważy moje zaufanie, będę trzymał akcje oceniając ryzyko i dostosowując do tego swój udział w portfelu. Natomiast jeśli się w spółce coś niedobrego porobi, pojawi się jakikolwiek kłamstwo, złe lub nielogiczne działanie lub niedobra sytuacja będę usuwał papier z portfela bez sentymentu. To jest mój model inwestowania.
Na dzisiaj - w odniesieniu do Scope, jego historii, ludzi, tego co zrobili, do czego dążą, uważam, że prawdopodobieństwo osiągniecia sukcesu jest bardzo wysokie. W szczególności ostatni czas , który myślę, że zmieni mocno nasz świat- tam szybka diagnostyka na masowa skalę będzie miała swój wielki udział i mam nadzieję, ze Scope Fluidics to wykorzysta. Jeśli tak się podzieje, to zwracam uwagę, ze będzie pierwsza polska spółka , które osiągnie taki sukces w szeroko pojętej diagnostyce lub szerzej medycynie i wtedy emocje mogą wielu uczestnikom rynku przesłonić racjonalną wycenę tego podmiotu.
|
|
Temat:
SCPFL
Bacteromic- zakończenie kolejnego milestona. Wszystko w terminie i zgodnie z harmonogramem podobnie jak dzień wcześniej zakończenie milestona PCRone. Gratulacje. Moim zdaniem, w tych okolicznościach to szczególnie zasługuje na uznanie. infostrefa.com/infostrefa/pl/w...strefainwestorow.pl/wiadomosci...Element ryzyka w odniesieniu do kolejnych działań to oczywiście testy zewnętrzne , lecz będzie to dopiero etap drugi, który rozpocznie się dopiero po przeprowadzeniu pierwszego etapu testów w siedzibie spółki. Miejmy nadzieje, ze do tego czasu gospodarki zostaną odblokowane i wszystko ruszy bez przeszkód.
|
|
Temat:
SCPFL
Właśnie o tym myślałem, że spodziewam się takiego infa (o dofinansowanie z UE do panelu SARS CO-2) a dzisiaj w parkiecie potwierdzenie, ze działają i w połowie marca o to wystąpili Natomiast Scope Fluidics podkreśla, że od połowy ubiegłego miesiąca aktywnie działa w zakresie pozyskania finansowania na certyfikację i wdrożenie produkcji testów wykrywających SARS-CoV-2 ze środków Unii Europejskiej.
Oczywiście rozważamy również udział w naborze wniosków NCBiR w ramach szybkiej ścieżki do walki z koronawirusem - potwierdza Szymon Ruta, członek zarządu spółki. www.parkiet.com/Medycyna-i-zdr...
|
|
Temat:
SCPFL
|
|
Temat:
SCPFL
Coraz więcej pokazywane jest takich szybkich testów genetycznych ale każdy z nich oparty jest na technologii izotermalnej. Przypomnę - w diagnostyce genetycznej poza metodami PCR są też metody izotermalne tj. amplifikacja (namnażanie) materiału genetyczne RNA lub DNA odbywa się w stałej temperaturze. Są znacznie młodsze metody ale coraz bardziej popularne. Bardziej złożone chemiczne, trudniej stworzyć równoległą identyfikację genów czyli markerów tj. trudniej jest robić tzw. multiplexing.
Do koronowirusa wystarczą na dzisiaj 3 markery i tam takie testy są jak najbardziej ok , ale jutro bakteria antybiotykoodporna taka lub inna, a tam już one nie wystarczą. Dlatego trzeba mieć system szybki (PCRone 15 min) o modyfikowalnych panelach (PCRone przygotowany jest na każdy patogen) na co najmniej 8-15 markerów, ponieważ system kupuje się na lata. Zwracam uwagę, że na koronawirusa wg. oficjalnych danych umarło do tej pory 82 tys. ludzi, na grypę umiera rocznie ok. 600 ty. ludzi, na bakterie antybiotykooporne 700 tys. a WHO przewiduje , że w 2050r będzie to 10 mln ludzi rocznie. Więc uświadomienie zagrożenia przez media może łatwo napędzić kolejną panikę, a taka firma kupująca system musi być na to przygotowana i wykorzystać to sprzedażowo.
|
|
Temat:
SCPFL
Takie deklaracje dodania/opracowania panelu na dowolny patogen w ciągu kilku m-cy/ na etapie wewnątrz firmy, padały już pół roku temu, gdzie nikt nie słyszał o koronowirusie. Opierały się one na takim stworzeniu panelu aby był w pełni modyfikowalny i "zaprojektowany nieco nadmiarowo" właśnie na przyszłe patogeny.
Tutaj w przypadku wirusa dochodzi dodatkowo opracowanie tzw. reakcji odwrotnej czyli transkrypcji (przejście z RNA do DNA). Pytasz czy podołają ? Do tej pory wszystkie ich deklaracje były realizowane a harmonogramy podtrzymywane, wiesz , ze na rynku (jak i w życiu) to wielka, wielka rzadkość. Wiec dla mnie dopóki to twa, nie mam prawa zakładać, że tym razem będzie odwrotnie. To statystyka i logika.
A prywatnie, rozmawiałem wiele razy z tymi ludźmi, widziałem co mówią i jak mówią, widziałem, z kim mamy do czynienia, wiec jak- jestem z dużą doża prawdopodobieństwa przekonany , ze tak właśnie będzie.
|
|
Temat:
SCPFL
W diagnostyce genetycznej poza metodami PCR są też metody izotermalne tj. amplifikacja (namnażanie) materiału genetyczne RNA lub DNA odbywa się w stałej temperaturze. Są znacznie młodsze metody ale coraz bardziej popularne. Bardziej złożone chemiczne, trudniej stworzyć równoległą identyfikację genów czyli markerów tj. trudniej jest robić tzw. multiplexing. Geomtec- rok temu chyba było ich 7 osób wtedy w wypożyczonych laboratoriach. Niespecjalnie wówczas byli zainteresowani certyfikacją do celów medycznych, wiedzieli swoje urządzenie w weterynarii, rolnictwie (badania gleby) itp. Jak czytam na ich stronie w grudniu 2019 dostali grant , przenieśli się do nowych laboratoriów i dokupili sprzęt, poszerzyli też zespół do 11 osób (m.in. specjalistów do oprogramowania i mikrobiologii) tzn. wcześniej tych ludzi po prostu nie było. W dalszym ciągu nie mają zaplecza mikrofluidyki bo korzystają z niemieckiego Microfluidic Chipshop, który jak mówią im projektuje kartę. Na ich stronie nie mogę przeczytać o żadnych badaniach w zewnętrznych laboratoriach. Sama spółka przyznaje , że komercyjna wersja ID będzie gotowa do końca 2021, jednocześnie "już za nawet 5-7 tygodni, będziemy w stanie zaoferować certyfikowany zestaw diagnostyczny w kierunku SARS-CoV-2 na terenie Unii Europejskiej. Ten produkt będzie kompatybilny z urządzeniami już istniejącymi na rynku ". Kompatybilny z jakimi ?, wszystkimi ? przecież każdy system ma inne rozwiązania, a może chodzi o urządzenia oparte na metodach izotermalnych ?. Za dużo niewiadomych, za mały zespół dopiero teraz rozszerzany. 5-7 tygodni ? a gdzie badania zewnętrzne, nie mówiąc o badaniach do certyfikacji. W przypadku kartidżu na MRSA Scope Fluidics procedura to badania wewnętrzne, badania zewnętrzne, poprawa architektury kartidżu, znowu badania zewnętrzne dopiero jak wszystko gotowe to badania certyfikacyjne. To wszystko trwa (nawet przy założeniu wszystkich specjalizacji w ramach zespołu), a w Geomtecu wszystko idzie bardzo, bardzo szybko. Ja za bardzo tego nie kupuję jako konkurencję do PCRone – przynajmniej na razie. Co nie znaczy , że może coś wprowadzą na rynek – teraz świat potrzebuję testów jak powietrza, genetyczne PCR bardzo drogie, serologiczne mało dokładne, wiec może oni coś powalczą, ale jako całość a do tego konkurencja PCRone to chyba raczej nie.
|
|
Temat:
SCPFL
Chciałbym się podzielić, jak ja na dzisiaj oceniam spółkę Scope Fluidics. Zacznę od tego, że moim zdaniem (to wnioski z dostępnych źródeł i stosowanej praktyki ) testy molekularne to przyszłość- nie bez przyczyny reakcje PCR nazywane są „złotym standardem” w diagnostyce. Wszystko inne, w diagnostyce, używa się oczywiście, ale jeśli jest wybór to nie ma żadnej dyskusji – szybkość, dokładność nie stwarza żadnej inne alternatywy. Dlatego obecna sytuacja, w moim przekonaniu, wytwarza dla Scope Fluidics o wiele większa szanse i stawia ich w zupełnie innym miejscu niż było to pół roku temu. Panel wirusowy na panel wirusowy SARS-Cov-2 czy inne firmy pracują nad tym, pewnie – mamy chociażby Genomics czy GenExpert , pewnie będą się pojawiać kolejne ale PCRone posiada atuty, którego nie maja inne urządzenia jest najszybszym aparatem na świecie oferujący do 20 markerów (reakcji PCR) jednocześnie.
Rozważmy pilną potrzebę na dzisiaj , ale na inne przyszłe okresy grypowo-wirusowe tj. zapobieganie epidemii czy pandemii poprzez stosowanie screeningu na lotnisku (ale może być to przejście graniczne, terminal dworca autobusowego itp) – wychodzi tłum pasażerów, odbywa się badanie temperatury każdego człowieka, tych z podwyższoną temperaturą kierujemy na dokładne badanie molekularne. Po 15 min wiemy czy stanowią zagrożenie czy też nie. System doskonały. Przy zwiększaniu ilość czasu badania do 30, 45 , 60 min – rośnie liczba oczekujących na wynik pasażerów, trzeba im zapewnić kolejne pomieszczenia ale tak aby potencjalnie nie zarażali się jednej od drugiego, logistyczne wyzwanie… Dlatego czas to czynnik nr 1 w takim screeningu- to element bezdyskusyjny.
Pieniądze – czy koszt pojedynczego panelu. Panel wirusowy do PCRone ma kosztować kilka euro czy USD a do innych znanych nam systemów jest to kilka/kilkanaście razy więcej. Przy okazjonalnym badaniu może to nie jest wielki temat, ale w obecnym czasie konieczności/lub chęci masowych screeningów to wielki argument i kto będzie chciał wprowadzić takie masowe procedury, wcześniej bardzo dobrze to policzy, możemy być tego pewni.
Chciałbym w tym miejscu wytłumaczyć o co chodzi z tymi markerami ? PCRone do 20, inne systemy od 1 do 50. Zrobię to na przykładzie gronkowca złocistego, ale można to odnieść do każdego dowolnego patogenu- bakterii, wirusa itp. Wiemy, że w patogenach co roku pojawiają się mutacje/alternatywnie inne rodzaje (z podobnego powodu wprowadza się co roku inne szczepionki na grypę) i dlatego trzeba reagować szybko. Panel, który prawidłowo oznaczał w zeszłym roku, w tym jest już do modyfikacji bo bakteria zmutowała i ma dodatkowy gen oporności na kolejny antybiotyk. Firmy wprowadzające te systemy na rynek wiedzą to oczywiście dobrze i siadają do rozmów z żądaniami możliwości jednoczesnego oznaczania przez system 8-15 markerów jako min. ich liczbę. Np : przy gronkowcu złocistym obecnie wymagamy rozpoznania genu samego gronkowca, 2 geny oporności, dodatkowe 3 markery pracują po to aby potwierdzić, czy gen oporności znajduje się w genomie gronkowca a nie innej bakterii. Razem 6 równoległych reakcji PCR (tzw. markerów) a rok temu było wymagane mniej….. Panel do PCRone można dowolnie modyfikować na dowolny patogen, bakterię lub wirusa i ma możliwość przeprowadzenia aż 20 reakcji PCR w czasie kilkunastu minut. To jest kluczowe zestawienie użyteczności systemu .
Czy inne firmy mogą opracować podobne urządzenia, być może , niczego nie można wykluczyć, ale średnia czasu wprowadzenia urządzenia diagnostycznego na rynek wynosi 8 lat. Jeśli wrzucimy pieniądze, duże pieniądze to czas pewnie skrócimy, ale na końcu każdego łańcucha jest laboratorium i ludzie, ich pomysły oraz to co muszą sprawdzić i zweryfikować, a to trwa. Nawet zakładając, że coś podobnego się nagle pojawi, to czy PCRone się nie sprzeda, oczywiście, że się dobrze sprzeda, zważając na argumenty przedstawiane jak wyżej.
Na koniec, napiszę brutalnie, za dużo czasu poświęciłem na tę półkę, aby nie wiedzieć co właściwie robią i jak robią, punt za punktem realizując założony harmonogram. Dla mnie ważne są fakty i wychodzące z nich wnioski a nie emocje. Niezbyt interesują mnie falujące ceny od 60 do 200 zł, ponieważ w moim przekonaniu najważniejsze jest czy są w stanie certyfikować, zarejestrować i sprzedać swój pierwszy system czy PCRone. Osobiście oceniam to w bardzo wysokich wartościach prawdopodobieństwa. Jaką cenę mogą uzyskać , nikt tego oczywiście nie wie, w tym pewnie wraz z zarządem spółki ale pamiętajmy zakładając możliwą kapitalizację, że za rok dodatkowo będzie skończony kolejny system tj. Bacteromc. W moim przekonaniu to znakomita firma, z poukładanymi ludźmi, mogąca przedstawić globalne systemy diagnostyczne. A jeśli tak się stanie, to cena transakcyjna będzie tylko jednym z elementów kształtowania się kapitalizacji spółki, ponieważ zmieni postrzeganie szeroko pojętej polskiej biotechnologii i nagle wszyscy zauważą Scope Fluidics a dodatkowo w cenach pojawią się nadzieja i oczekiwana na przyszłość nie w odniesieni do startupu, tylko do spółki, która już pierwsze swoje urządzenie sprzedała i szykuje się do sprzedaży kolejnego.
|
|
Temat:
PURE
Po piątkowych notowaniach, trzeba zwrócić uwagę, ze fundamenty spółki pozostały bez zmian, tutaj nic się nie zmieniło. Z drugiej strony jasne jest, że w takich masowych panikach, najmniej się ma ochotę inwestować z spółki biotechnologiczne (tj. wysokiego ryzyka) , które do tego prawdziwe efekty swoich działań ukażą za pół roku, rok czy dłużej. Tak działa mózg człowieka tj. inwestora a raczej jego emocje.
Dla mnie to mega okazja wyprzedaży po śmiesznych cenach.
|
|
Temat:
PURE
Uwagi po konferencji inwestorskiej Pure Biologics, która odbyła się w dniu 26.02.2020r
Zastrzeżenia :
Nie przedstawiam spółki od początku, ale same najważniejsze zagadnienia po ostatniej konferencji spółki dla tych, którzy ją obserwują i się nią interesują. Zainteresowanych odsyłam do swojej całościowej analizy spółki z 10.2019 i update po raporcie z III kw z 11.2019, które opublikowałem się na tym forum.
Zaznaczam też, nie mam przygotowania z biotechnologii, więc mogą się zdarzyć przeinaczenia elementów naukowych, lecz idea jest inna- to tekst napisany przez inwestora dla inwestorów w celu lepszego zrozumienia specyfiki spółki, pracującej w bardzo trudnej dla laika branży jaką jest biotechnologia a co za tym idzie dokonania własnego podsumowania analitycznego.
1) Projekt lekowy Multibody PB001 – najbardziej zaawansowany projekt. N obecnym etapie mają 5 przeciwciał, które wiążą pierwszy cel molekularny oraz drugi cel molekularny, a co ważniejsze wiążą dwa te cele jednocześnie. Kwestia stabilności - bardzo ważne jest stabilność przeciwciał m.in. w różnych temperaturach, czasie itp. Jak w laboratorium uzyskuje się różne nawet najlepsze przeciwciała to bez stabilność za dużo to nie znaczy. Obecnie kończą panel stabilności dla tego projektu. Dotychczasowa analiza stabilności wychodzi pozytywnie. Stabilność przeciwciał bispecyficznych projektu multibody jest zbliżona do stabilności „tradycyjnych” przeciwciał monospecyficznych..
Pytałem o toksyczność – odpowiedź : badania trwają ale póki co nie obserwują żadnych istotnych toksyczności w modelach komórkowych.
Przedklinka tj. badania przedkliniczne- kiedy mogłyby się zakończyć do tego projektu? – przedklinika w zakresie in vitro prawdopodobnie do końca roku. Potem wstępne badania na zwierzętach + faza z dokumentacją GLP 1-1,5 roku. W standardowym modelu jest też badanie 0,5 roku na małpach (drugi gatunek zwierząt), jednak przy lekach biologicznych a w szczególności immunologicznych jeżeli wykażą naukowo, ze to bezcelowe (bo jest to inny system immunologiczny i nie osiągną żadnych wniosków z tych badań) to wtedy regulator może zwolnic z tej fazy badań i na to liczą. Czyli mowa jest o pełnym zakończeniu testów przedklinicznych min. 2 lata a prawdopodobne nawet 2,5 roku od dzisiaj czyli początek 2022 do połowy 2022 .
Gotowość do parteringu planują osiągnąć po 3,4 miesiącach rozpoczęciu testów na zwierzętach – czyli prawdopodobnie połowa 2021r . Gotowość oznacza, że mogą ale nie muszą zawrzeć umowy parteringowe , bo im dalej zajdą w badaniach tym są większe pieniądze z upfrontu.
Pierwsze pieniądze upfronty – połowa umów na rynku oscyluje w ok. ok. 30 mln usd. Takie umowy zawierane są we wczesnych fazach , zazwyczaj przedklinice w immuonkologii to standard. W zależności od stopnia zaawansowania tej przedklniki, wartości są zupełnie różne- najmniejsze oczywiście na początku , największe na końcu. Jeśli chodzi o podaż tego rodzaju przeciwciał do parteringu to jest mniejsza niż popyt od strony partnerów tj. Bigfarmy. Na spotkaniu jako transakcje referencyjne pokazana została większość transakcji z małymi firmami (kilkadziesiąt osób) i dla niektórych z nich były to pierwsze umowy parteringowe.
2) Projekt lekowy PureActivator PB003 – drugi najbardziej zaawansowany projekt lekowy za Multibody
Założenie jest takie aby drugi projekt wchodził do przedklinki 0,5 roku po pierwszym, tak się te projekty zaczęły i tak są rozplanowane.
Ważne jest też zdobywanie kompetencji – tj., to czego uczą się w projekcie Multibody mogą zastosować gdzie indziej. To są te same testy komórkowe, które zastosują w kolejnych projektach – czyli kolejne testy będą posuwać się szybciej, to co zajęło w Multibody np. 6 m-cy, w kolejnych powinno zająć 5 miesięcy czy 4 m-ce. Wiele metod jest wspólna.
3)Projekt terapeutyczny PB002 AptaPheresist
Najważniejsza rzecz na dzisiaj to uzyskanie prototypu laboratoryjnego i koncepcji w laboratorium i to zostało zrobione. Co istotne , że zrobili to w osoczu, które nie jest łatwe, jest lepkie i trudne do pracy, na rzeczywistym materiale pobranych od ludzi chorych na Zespół Devica.
Prezentacja wyników - nie mogą tego zrobić, w najbliższych miesiącach wyniki muszą być przedstawione najpierw na konferencji naukowej, potem je udostępnią szeroko. Ale udowodnienie samego mechanizmu otwiera im drogę do szerszego podejścia samej aferezy jako celowanej w kolejnych wskazaniach.
Jakie pieniądze z projektów terapeutycznych- nie ma transakcji referencyjnych, ale upfront to raczej kilka mln usd,.
Prawdopodobny czas parteringu - zakładają możliwość wcześniejszego rozglądania się za parterem (niż w projekcie Multibody), ten proces badań przedklinicznych jest bardziej uproszczony i tak naprawdę już pokazanie prototypu funkcjonalnego , bez badani na ludziach wystarczy aby poważnie rozmawiać o parteringu.
4) Kiedy dojdą kolejne projekty badawcze ? -przez 2 lata nie będą rozszerzali pipeline badań, czyli do początku 2022, bo potem większość programów wejdzie do późnej przedkliniki lub nawet klinki i to będą to robić partnerzy. Uwolnią się zasoby ludzkie oraz laboratoryjne i będzie można otwierać kolejne tematy a być może zgra się to z nową perspektywą na wykorzystanie środków publicznych.
5) Nowe osoby w zespole
Dr Richard Fox jest dyr. ds. przedklinicznych - ma bardzo duże doświadczenie, robił badania przedkliniczne + łączy dodatkowo kompetencje immnoonkologiczne. Zajmuje się zakresem : od późnych badań komórkowych ponieważ badania przedkliniczne rozpoczynają się od kultur komórkowych (m.in. na komórkach układu odpornościowego izolowanego od dawców, oraz na wycinkach biopsji), po to aby być pewnym , ze podaniu myszy mają szansę być skuteczne i mieć odpowiednie bezpieczeństwo toksykologiczne.
Dr Michał Surma i badania kontraktowe – doktorat w Dreźnie, świadczył usługi analityczne, w portfolio największe firmy. Główny przesłaniem jest zamiast skupiać się w badaniach kontraktowych na jednym elemencie (np.: na oczyszczaniu białek), proponować kompleksowe rozwiązania dla firm od A do Z. Jako PB mają doświadczenia, kompetencje i know-how.
Po co badania kontraktowe , skoro możliwe do uzyskania wartości są krotnie niższe niż wartości samych programów badawczych - sam kontakt z rynkiem, przyglądanie się czyimś problemom (konkurencji), jest dobry a raczej niezbędny. Zdobywają know-how, prezentują platformy i firmę na zewnątrz.
6)PB jest beneficjentem programu „Go to brand” – w ramach tego w planach jest 5 konferencji w 2020r zarówno naukowe, parteringowe jak i wystawianie się w zakresie usług naukowych. Będą szukać klientów i partnerów.
7)Finanse- w kasie na koniec 2019 było blisko 14 mln (ponad 9 mln z zaliczki z NCBiR-u) . To olbrzymia, pozytywna, zmiana w podejściu. Wcześniej emisje były potrzebne na kapitał obrotowy - musieli wydawać, rozliczać zaliczki z NCBiR-em + trzymać bufor gotówki jak cos się opóźni, teraz rozliczają całość W mniejszej mierze korzystają z kapitału własnego a przede wszystkim z pieniędzy zaliczkowych. Za kilka miesięcy będą wiedzieli, czy ten model są w stanie kontynuować (decyzja NCBiR-u).
8) Kiedy emisja – wiadomo, ze emisja być musi, wynika to z prostej matematyki i analizy wkładu własnego w odniesieniu do wielkości projektów i pozyskanych kapitałów, ale zdają sobie sprawę , ze im później, tym badania będą dalej zaawansowane i wyższa wycena spółki a wiec mniejsze rozwodnienie. W interesie spółki i akcjonariuszy im później przeprowadzona zostanie emisja akcji, tym lepiej. Wiele zależy od NCBiR-u i jego dalszego finansowania zaliczkowego. Zgadzam się z tym całkowicie.
Podsumowanie- coraz lepsze struktury organizacyjne, nabywane kompetencje, specjaliści wysokiej klasy z wielu dziedzin, zaliczkowe pieniądze z NCBiR-u, idące do przodu 3 projekty lekowe i 3 projekty terapeutyczne jako minimalizowanie ryzyka. W mojej opinii w cenie na rynku nic, albo bardzo niewiele. Jakakolwiek komercjalizacja tj. partering – co przy 6 projektach jest bardzo prawdopodobne, może wnieść kurs kilka razy wyżej od dzisiejszych cen, ponieważ poza pieniędzmi wniesie zaufanie do spółki i będzie dyskontować przyszłość. W przypadku kilka komercjalizacji, lub dalszych pozytywnych realizacji etapów przez partnerów powyżej fazy przedklinicznej „sky is the limit” (ale to perspektywa kilku lat). Ryzyka czy są? – oczywiście to biotechnologia oraz programy badawcze dlatego ryzyka oczywiście istnieją, najważniejsze ryzyka to : posypanie się badań, brak finansowania lub odejście kluczowych osób. Ale jak wspomniano powyżej trzeba też pamiętać, że ryzyka te są zarządzane i ograniczane – spółka posiada 6 programów badawczych dofinansowanych z NCBir-u, zaplecze ludzkie o wysokich kompetencjach, pieniądze na badania.
W mojej opinii Pure Biologics to jedna z ciekawszych spółek na polskim rynku biotech a zważając zysk/ryzyka przy obecnej kapitalizacji, uważam, że najciekawsza. Oczywiście elementem niezbędnym, aby taką spółkę mieć w portfelu jest konieczność monitorowania postępów prac czyli ciężka inwestorska praca –przebijanie się przez trudne zagadnienia biotechnologiczne, obecność na konferencjach, walnych zgromadzeniach, analizowanie raportów kwartalnych oraz bieżących. Jednak nagroda za tą pracę może być naprawdę bardzo interesująca.
|
|
Temat:
PURE
|
|
Temat:
PURE
Właśnie otrzymałem informację z Innervalue, o zapowiadanym kilka m-cu temu spotkaniu ze spółką które odbędzie się 26 lutego 2020 r. (środa) o godzinie 15:00 w centrum konferencyjnym DAGO Centrum w Warszawie, przy ul. Rondo ONZ 1. Tematem spotkania będzie aktualizacja postępów w innowacyjnych projektach Spółki. Jak wynika z informacji, jest prośba o potwierdzenie obecności na m.michalewska@innervalue.plJeśli ktoś na poważnie interesuje się spółką i jej możliwościami, powinien przyjechać. W moim przekonaniu to jedyna droga aby bardziej racjonalnie ocenić co spółka robi i jakie ma w tym postępy. Porozmawiać z zarządem oraz osobami bezpośrednio odpowiedzialnymi za projekty. Aby sobie za rok czy dwa nie wyrzucać braku zainteresowania w tej jednej z najciekawszych moim zdaniem na polskim rynku spółce biotechnologicznej. Osoby które były na poprzednim spotkaniu wiedzą o czym piszę. Zachęcam przyjechać i wyrobić sobie zdanie, to najlepsza droga do świadomego inwestowania w takie podmioty. Ja oczywiście będę.
|
|
Temat:
SCPFL
|
|
Temat:
SCPFL
Odpowiadając na Twoje pytanie Seneca - wg. mojej najlepszej wiedzy są przygotowani do replikacji DNA i RNA. Czip jest tak zaprojektowany, iż można go w kilka m-cy skonfigurować i wewnętrznie przebadać aby wykrywał każdy patogen. Problematyczne jest zawsze na pierwszym miejscu oczyszczenie próbki i tzw. liza czyli zniszczenie błony komórkowej aby dostać się do DNA lecz tutaj zacytuję słowa Kamila Gewartowskiego jakie zapamiętałem, że „nie wyobraża sobie trudniejszej lizy niż MRSA”. Wiec mój wniosek jest taki, ze chyba nie byłoby problemu z wykryciem koronawirusa.
|
|
Temat:
SCPFL
Zostawiając na boku dyskusję czy koronawirus to faktyczne zagrożenie ogólnoświatowe czy tylko medialna histeria jakiś było mnóstwo i pewnie będzie w przyszłości równie wiele, reakcja PCR jest zdaje się jedyną na poważnie rozważaną diagnostyką wykrywania tego wirusa. www.businessinsider.com/how-to...Pewnie w tym kontekście trzeba rozpatrywać ostatnią wypowiedż p. Szymona Ruty Wyraźne zainteresowanie systemem PCR|ONE wyrażali również przedstawiciele branży diagnostyki medycznej z Chin. Rozmowy te obecnie kontynuujemy drogą mailową – mówi Szymon Ruta, członek zarządu – dyrektor finansowy Scope Fluidics
|
|
Temat:
PURE
|
|
Temat:
SCPFL
Kolejny element harmonogramu zaliczony perfekcyjnie pod względem realizacji założonych zadań oraz planowanego czasu. To oczywiście znakomite potwierdzenie tego co robi spółka.
Co teraz przed nimi ? i tu przypomnę fragment mojego wpisu z początku grudnia 2019r
Pod koniec przyszłego roku duże testy kliniczne na systemie Bacteromic. Docelowo po rozmowach w Polsce i konsultacjach w Londynie (z dr Davidem Wareham, członkiem międzynarodowego komitetu doradczego, kierownikiem największego w Londynie laboratorium mikrobiologicznego w szpitalu Queen Mary) będzie to prawdopodobnie 57 wybranych antybiotyków + dodatkowo 4 dodatkowe mechanizmy oporności. To optymalna wg. klinistów ilość antybiotyków. Zostawia to sporo miejsca na płytce, na testowanie kombinacji antybiotyków w przypadku trudnych zakażeń. Ponadto otwiera nowe możliwości wykorzystania urządzenia przez firmy, które produkują antybiotyki i poszukują takich systemów - z ich strony jest już teraz bardzo wstępne, duże zainteresowanie, ponieważ żaden z obecnych na rynku systemów nie spełnia ich wymagań.
Wyzwania - know-how przemysłowe aby antybiotyki stabilnie czekały w próbce, dla większości antybiotyków jest ta stabilność łatwa, dla niektórych antybiotyków nie jest to oczywiste. Po któryś z ich wystąpień na międzynarodowych kongresach zgłosiła się firma, która dostarcza antybiotyki i technologie ich nakładania do najważniejszych konkurentów. W interesie tej firmy jest aby ich wesprzeć,. Kolejnym wyzwaniem (raczej wyzwaniem czasowym) jest sprawdzanie każdego nowego wprowadzanego na panel antybiotyku z metodami referencyjnymi. To bardzo dużo pracy, ale jak twierdzą w pełni wykonalne w określonym harmonogramem czasie. Mają olbrzymie zainteresowanie od laboratoriów na całym świecie aby przetestować system Bacteromic na szczepach klinicznych. Na moje pytanie (w czasie spotkania) – czy dadzą radę zakończyć projekt w terminie? - odpowiedź jest jednoznaczna, operacyjnie jak najbardziej tak – mają zespół kompetentnych ludzi, mają pomoc uznanych naukowców, członków międzynarodowego komitetu doradczego.
|
|
Temat:
PURE
Byłem obecny na grudniowym walnym Pure Biologics jako jedyny inwestor indywidualny. Pewnie dla wielu osób będzie interesująca wiadomość, że w akcjonariacie spółki jest Rząd Norwegii (i to nie są powszechnie występujące w spółkach na GPW fundusze Norweskie). Osoba upoważniona przyjechała specjalnie z Warszawy na walne i zapowiedziała, że będą uczestniczyli w każdym WZA.
Dla mnie to bardzo pozytywne info., na teraz i na przyszłość.
|
|
Temat:
PURE
Pozytywna informacja : poprzez zwiększenie płynności na spółce , jak i sam fakt, iż potrafili sobie wypracowac z NCBiRem taką zaliczkę, co nie jest powszechne Zarząd Pure Biologics S.A. (Spółka, Emitent) informuje, że Narodowe Centrum Badań i Rozwoju (NCBR) pozytywnie rozpatrzyło wnioski Spółki i przyznało jednorazowe zaliczki, w łącznej kwocie 9.514.742,40 zł, na realizację projektów badawczo-rozwojowych: PB001 MultiBody, PB002 AptaPheresis, PB003 PureActivator, PB005 Apta-MG, PB010 PureSelect2. Tym samym do dnia 16 grudnia 2019 r. na rachunek spółki wpłynęła pełna powyższa kwota wnioskowanych zaliczek. Uzyskane w ten sposób środki mają znaczący wpływ na wielkość zaangażowania kapitału własnego Spółki w bieżącą realizację projektów B+R i zdecydowanie pozytywnie wpłyną na płynność Emitenta w najbliższych okresach, poprzez przeniesienie ciężaru finansowania badań z modelu refundacyjnego na system zaliczkowy. infostrefa.com/infostrefa/pl/w...
|
|
Temat:
SCPFL
TOTAL FIZ objął wszystkie akcje serii F oferowane w ramach subskrypcji prywatnej w dniu 13 grudnia 2019r Cena emisyjna za jedną akcję wyniosła 60,00 zł. Łączna cena emisyjna za wszystkie akcje serii F wyniosła 13.892.400 zł. Cena za akcje serii F została opłacona wkładem pieniężnym na rachunek bankowy Emitenta. infostrefa.com/infostrefa/pl/w...
|
|
Temat:
SCPFL
W dniu 4 grudnia byłem obecny na spotkaniu wraz z funduszami w spółce w ramach no deal roadshow, poniżej moje spostrzeżenia i obserwacje .
Osoby, które jeszcze nie czytały odsyłam do mojej opublikowanej sprzed kilku tygodni całościowej analizy spółki , ponieważ poniżej znajduje się uszczegółowienie poruszonych w niej zagadnień. W celu lepszego zrozumienia tematyki, odsyłam także do zamieszczonych na stronie spółki prezentacji inwestorskich.
Spotkanie rozpoczęto od pokazania krótkiego filmu o uruchomionym zakładzie produkcyjnym w którym zakończono półautomatyczną linię do montażu chipów do PCRone. W jednej przestrzeni składającej się z kilku śluz i poziomów wydzielono część do składania Bacteromica, część do PCRone i do składania chipów do PCRone. To co już zostało wykonane (linia do chipów), był to najtrudniejszy element ze względu na wymaganą przy niej absolutną czystość, wpływającą na jakość składanych chipów. Reguluje to wdrożona przez spółkę odpowiednia procedura ISO mówiąca o czystości, powtarzalności, organizacji i dokumentacji. Te realizowane elementy są konieczne do objęcia poszczególnych linii systemem jakości wymaganym jako element konieczny w procesie certyfikacji.
Następnie przystąpiono do prezentacji kierowników projektów, po prezentacjach obejrzeliśmy laboratoria. Pierwszy z omawiających, dr Kamil Gewartowski kierownik projektu PCR|ONE rozpoczął od podkreślenia, iż system służy do wykrywania każdego dowolnego patogenu np.: wirusów czy bakterii. Nawiązując do tego o co pytali potencjalni nabywcy- czy można wykrywać taki lub inny patogen, tu odpowiedź jest jasna, iż nie ma problemu z technicznego punktu widzenia. Oddzielną sprawą jest oczyszczenie próbki do reakcji, ale całość jest w pełni wykonalna. K.Gewartowski opowiadał następnie o samym urządzeniu PCR|ONE, zaletach jego rozwiązań technicznych w odniesieniu do konkurentów (szczególnie szybkość 15-20 min. jest tutaj niezwykle ważna i ceniona). Na samym chipie pozostawiono sporo miejsca aby łatwo go było przemodelować na potrzebę wykrywania każdego patogenu lub nowego genu oporności. Zwracał dużo uwagi, że panel MRSA (planowany do certyfikacji) nie wykrywa jedynie bakterii gronkowca jako takiej ale także dodatkowo tzw. geny oporności (na dany antybiotyk). Przy takiej informacji lekarz może rozpocząć zupełnie inne leczenie niż w przypadku „zwykłego” gronkowca, które bez niej mogłoby zupełnie nieskuteczne. Nie dość tego, wskutek mutacji szczepów bakterii obecnie niemal każdego roku przybywa jakiś gen oporności i można przewidywać, że w przyszłości będzie tego coraz więcej a chip już jest przygotowany do kolejnych modyfikacji. Niektóre systemy konkurencji maja z tym problemy bo mogą w jednakowym czasie wykonać tylko kilka reakcji PCR i ich informacja jest niepełna tj. nie wykrywają wszystkich wymaganych genów oporności. Niektóre z firm nie mogą też tego zrobić, bez kompletnej przebudowy systemu, co będzie kosztowała, trwało i być może będzie konieczne wycofanie starych systemów z rynku. PCRone i jego chip ma tutaj znakomita przewagę. Zakażenie gronkowcem złocistym jest dzisiaj największym zagrożeniem dla szpitali (chodzi tu o przeliczalne i realne koszty pozwów), szpitale decydują się coraz częściej na screening wszystkich wprowadzanych do szpitali pacjentów np.: w Anglii każdy szpital to robił i jest tutaj obowiązek prawny.
Padały pytania o konkurentów, których zauważyli na ostatnich targach Medica w Niemczech (największych targach medycznych w Europie). Wg. informacji spółki pojawił się jeden ważny konkurent - system koreański, firma planują w przyszłym roku rejestrację w Europie: kilkadziesiąt minut czas analizy (30-40 min), reakcja do 11 genów.
Co teraz z PCR|ONE? chcą pokazać certyfikat na pierwszy panel MRSA oraz na samo urządzenie, to teraz najważniejsze. Jak sami mówią, ilość pracy do przygotowania systemu jakości linii jako wstęp do certyfikacji jest ogromna. Wiedzą, że to praca trudna i żmudna ale niezbędna. Pracują na wzmożonych obrotach. Jak to zakończą, zespół PCR|ONE, bierze się za nowe panele m.in. grypowy. Ich ideą aby w niedalekiej przyszłości u lekarza pierwszego kontaktu stał PCR|ONEi na jednym chipie można łatwo , w ciągu kilkunastu minut identyfikować np.: dwa wirusy grypy, kilka podstawowych bakterii które powodują przeziębienie. Lekarz otrzymując taką informację bardzo dobrze wie jak łatwo i skutecznie wyleczyć pacjenta. Wg. zespołu - dla nich praca nad przyszłymi panelami to przyjemność.
Padło pytanie o audyt czystości patentowej - wewnętrznie robią to regularnie, mają bardzo dobrych specjalistów z którymi współpracują od lat. Chcą przeprowadzić audyt zewnętrzny przez zewnętrzną wyspecjalizowaną kancelarię.
Kolejne pytanie padło o czas certyfikacji PCR|ONEi chipa MRSA i czy są już wybrane ośrodki? tak - są wybrane ośrodki kliniczne w Polsce badania będą prowadzone w czasie ok. 12 tygodni. Wymagane jest 1000-1500 badań, czyli od ok. 350-500/jeden ośrodek
Kierownik projektu dr Seweryn Bajer-Borstyn zaprezentował systemu Bacteromic zakończony zwiedzaniem laboratorium. Jak podkreślał siłą systemu jest kartidż z systemem 640 niezależnych komór hodowlanych. Omówiony został skomplikowany sposób napełniania komór z wykorzystaniem podciśnienia, nadciśnienia, oleju rozdzielającego poszczególne komory po napełnieniu. System działa bardzo dobrze i w połączeniu z ilością komór jest to szczególne know-how oraz przewaga spółki. Bezpośredni konkurent Vitek 2 (lider rynku) ma dołków 64, najmocniejszy na rynku jest system Phoenix z 136 dołkami. Ilość dołków jest elementem krytycznym i konkurencji muszą się decydować, czy dawać dużo antybiotyków z niewielka ilością zakresu stężeń czy niewiele antybiotyków w szerokim zakresie stężeń. Padały pytania o możliwości zmiany (poszerzenia) przez konkurentów ilość komór. Odpowiedź była mocna i jednoznaczna - nie da się łatwo zmienić ilości komór, nie zmieniając wielkości kartidża, jeśli więc Vitek 2 ma wypuszczone na rynek kilkanaście tys aparatów, aby to zrobić musiałby zmodyfikować swój kartidż jak i zamienić sam aparat. Phoenix ostatnio zdecydował się zwiększyć ilość antybiotyków kosztem ilości stężeń odpowiadając na potrzebę rynku ponieważ szpitale muszą wybierać i coraz często decydują się na testowanie dużej ilości antybiotyków. Fakt ten tylko upewnia zespół Bacteromica o tym co będzie potrzebne w przyszłości, tzn. czego chce rynek - bardzo duża liczba antybiotyków o szerokim zakresie stężeń, czyli pełna informacja diagnostyczna do leczenia pacjenta.
Co przed nimi ?– pod koniec przyszłego roku duże testy kliniczne na systemie Bacteromic. Docelowo po rozmowach w Polsce i konsultacjach w Londynie (z dr Davidem Wareham, członkiem międzynarodowego komitetu doradczego, kierownikiem największego w Londynie laboratorium mikrobiologicznego w szpitalu Queen Mary) będzie to prawdopodobnie 57 wybranych antybiotyków + dodatkowo 4 dodatkowe mechanizmy oporności. To optymalna wg. klinistów ilość antybiotyków. Zostawia to sporo miejsca na płytce, na testowanie kombinacji antybiotyków w przypadku trudnych zakażeń. Ponadto otwiera nowe możliwości wykorzystania urządzenia przez firmy, które produkują antybiotyki i poszukują takich systemów - z ich strony jest już teraz bardzo wstępne, duże zainteresowanie, ponieważ żaden z obecnych na rynku systemów nie spełnia ich wymagań.
Wyzwania - know-how przemysłowe aby antybiotyki stabilnie czekały w próbce, dla większości antybiotyków jest ta stabilność łatwa, dla niektórych antybiotyków nie jest to oczywiste. Po któryś z ich wystąpień na międzynarodowych kongresach zgłosiła się firma, która dostarcza antybiotyki i technologie ich nakładania do najważniejszych konkurentów. W interesie tej firmy jest aby ich wesprzeć,. Kolejnym wyzwaniem (raczej wyzwaniem czasowym) jest sprawdzanie każdego nowego wprowadzanego na panel antybiotyku z metodami referencyjnymi. To bardzo dużo pracy, ale jak twierdzą w pełni wykonalne w określonym harmonogramem czasie. Mają olbrzymie zainteresowanie od laboratoriów na całym świecie aby przetestować system Bacteromic na szczepach klinicznych. Na moi pytanie – czy dadzą radę zakończyć projekt w terminie ?- odpowiedź jest jednoznaczna, operacyjnie jak najbardziej tak – mają zespół kompetentnych ludzi, mają pomoc uznanych naukowców, członków międzynarodowego komitetu doradczego.
Co ja o ty myślę ?- widziałem i byłem w wielu startupach, tu spotykam, co jest rzadkością, kompetentny zespół specjalistów, realizujący ściśle określony realizowany harmonogram. Zespół nie boi się trudnych pytań, nie boi się wyzwań, otwarcie o nich mówi, mając określony plan działania. Pierwsza komercjalizacja PCR|ONEoraz chipa MRSA a wcześniej certyfikacja i rejestracja jest oczywiście kluczowa ponieważ uwiarygodni spółkę. Zespół jest zdeterminowany aby skończyć wszystko w terminie (trzeba też pamiętać o jego motywacji przydzielonymi akcjami fantomowymi, udana komercjalizacja będzie się wiązała ze sporą nagrodą). Co wówczas ? obecna kapitalizacja spółki, w razie udanej pierwszej certyfikacji i rejestracji a następnie sprzedaży, skoczy natychmiast do góry ponieważ nie będzie to już startup ale firma , która sprzedała i certyfikowała jedno urządzenie a prawdopodobnie w cenie znajdzie się i drugie.
Czy można mieć 100% pewność, ze bezproblemowo przebiegnie proces certyfikacji najpierw jednego a potem drugiego systemu oraz sama sprzedaż, oczywiście, że nie. Ale widząc, iż do tej pory wszystko było realizowane zgodnie z harmonogramem, widząc profesjonalistów mających pomoc merytoryczną najlepszych światowych autorytetów, wreszcie widząc determinację i konsekwentne zmierzanie do celu- uważam, ze prawdopodobieństwo jest naprawdę bardzo wysokie.
|
|
Temat:
SCPFL
|
|
Temat:
PURE
Ja bym dodał jeszcze niezwykle ważne elementy (a właściwie najważniejsze dla mnie)
- kto tworzy potencjał naukowy spółki (ludzie, ich kompetencje, ich doświadczenie, firmy w których pracowali itp)
- kto tworzy potencjał biznesowy spółki (ludzi, kompetencje, doświadczenie)
Dlaczego uważam, że to najważniejsze ?- dlatego, ze jak są dobrzy to pociągną najtrudniejszy temat a jak tacy sobie to położą najlepszy. W każdych spółkach a już w innowacyjnych to dla mnie zagadanie nr 1- mocno zweryfikować ich doświadczenie, poznać osobiście, monitorować , spotykać się i rozmawiać przy każdej możliwej okazji.
|
|
Temat:
PURE
Zastanawiałem się ostatnio, bo kto może ocenić sens działań spółki zajmującej się biotechnologią takiej jak np:Pure Biologics : student medycyny lub biotechnologii - wątpię, absolwent tych kierunków- również głęboko wątpię. Projekty na dziesiątki mln przechodzą przez ncbir gdzie analizowane są przez zespoły kompetentnych naukowców. Spółka mając w swoim składzie kilkudziesięciu dr biotechnologii i nauk pokrewnych, z całego świata, pokazywała by tematy, bez naukowego lub komercyjnego sensu wystawiając się na śmieszność i podważając swój autorytet - oceniam to jako nieprawdopodobne. Tu moim zdaniem rzecz idzie czy mają szansę doprowadzić projekty do komercjalizacji – a to można monitorować analizowaniem działań spółki zarówno tych naukowych jak i biznesowych. Jak mówi Paweł Przewięźlikowski z Selvity, amerykanie nauczyli się tego , ale za nimi stoi 40 lat doświadczeń inwestowania w branże biotechnologiczną , za polskimi inwestorami tylko kilka lat. Moje zdanie - trzeba mieć w tym zakresie kompetencje to jasne , ale jak wszystko na tym świecie można je zdobyć, jest tylko kwestia chęci i poświęconego na to czasu.
|
|
Temat:
SCPFL
Odnośnie tego raportu infostrefa.com/infostrefa/pl/w...To się staje już nudne, realizują wszystkiego kroki zgodnie z podanym harmonogramem :) Ale obyśmy tylko taką nudę mieli na rynku. Swoja drogą, ciekawe jak rynek zareaguje jak czegoś nie dotrzymają.....
|
|
Temat:
PURE
Update do analizy spółki Pure Biologics po raporcie za III kw 2019r,
Moja analiza spółki Pure Biologics ukazał się ok. m-c temu, a w międzyczasie pojawił się raport spółki za III kwartał br. Ponieważ raporty okresowe tej spółki wnoszą bardzo dużo merytorycznych elementów do jej lepszego rozumienia (spółka jest z jednej strony dynamicznie rozwija swój segment biofarmaceutyczny, a z drugiej strony działa w bardzo trudnej dla inwestora branży biotechnologicznej) zdecydowałem się opisać najważniejsze z zagadnień wniesionych ostatnim raportem jako update do wykonanej analizy spółki. Wiem oczywiście, że to wszystko można znaleźć w raporcie, jednak wydaje mi się, że warto na taki raport spojrzeć z inwestorskiego punktu widzenia, ponieważ pozwala postawić inne akcenty i uwypuklić sprawy ważniejsze niż sucha forma sprawozdania kwartalnego. A po drugie analizę takiego raportu spółki biotechnologicznej, która prowadzi projekty badawcze, należy, moim zdaniem, wykonać zupełnie inaczej niż typowego raportu kwartalnego.
1. Finanse - nie sposób na początek nie odnieść do finansów spółki, ponieważ one wnoszą bardzo dużo wiedzy o działaniach spółki
a) Przychody netto ze sprzedaży - spółka wykazała wartość 4 302,29 tys. zł. W tym sprzedaż produktów wyniosła 288,40 tys. zł oraz zmiana stanu produktów wyniosła 4 013,89 tys. zł. Dynamika przyrostu +77,44% do 2018 wskazuje na wzrost spółki w obu obszarach jej aktywności biznesowej (działalność B+R i badania kontraktowe). Zmiana stanu produktów po trzech kwartałach 2019r wynosiła 10544,40 tys. zł (do 9 m-cy 2018 4580,23 tys. zł)
Zmiana stanu produktów, przedstawia w zasadniczej części nakłady Spółki poniesione w danym okresie na prace badawczo-rozwojowe. Stosunek wartości pozycji „zmiana stanu produktów” w odniesieniu do wartości przychodów ze sprzedaży ogółem (93,29%) odzwierciedla pośrednio skalę aktywności w poszczególnych segmentach działalności Spółki (działalność B+R, badania kontraktowe)
b) Przychody netto ze sprzedaży produktów Przychody z działalności komercyjnej opartej o badania kontraktowe świadczone na rzecz firm farmaceutycznych osiągnęły za III kwartał br. wartość 288,40 tys. zł (1 300,78 narastająco po 3 kwartałach) i były niższe o 29,48% w stosunku do wyników w analogicznym okresie roku 2018. Jak pisze spółka spadek wartości przychodów ze sprzedaży badań kontraktowych wynika z głównie z różnej długości trwania zakontraktowanych badań, a co za tym idzie nieproporcjonalnym w czasie fakturowaniu usług. Na spadek przychodów ma również wpływ przeznaczenie części osobowych zasobów naukowo badawczych wyłącznie do przygotowania własnych projektów B+R, które uprzednio w większej mierze wykorzystywano do prac w obszarze działalności komercyjnej.
Wiosek – dla mnie to czyste i logiczne działania: zasoby ludzkie przesuwane są na obszary projektów B+R, w których są potrzebne i które stanowią o wartości spółki obecnie a przede wszystkim w przyszłości.
c) Środki pieniężne - Cash is king, to prawda znana nie od dzisiaj, ale w spółce innowacyjnej nabiera szczególnego znaczenia. Na koniec okresu III kw. środki pieniężne wynosiły 4 342,31 wobec 6 348,21, czyli w II kw. wydane zostało ok. 2 mln zł, wobec tego jasnym jest, ze emisja ( uwzględniając środki obrotowe, które Spółka wykorzystuje do finansowania comiesięcznych całkowitych kosztów projektowych , które czekają prze okres 2-3 miesięcy na rozliczenie z NCBR) musi nastąpić w I/II kw2020r
W tym miejscu przypomnę kilka informacji z mojej całościowej analizy, dlaczego ta emisja i na co ma zostać przeznaczona.
Jak wszyscy wiemy, ostatnia emisja była w kwietniu 2019r i miała w założeniu starczyć na rok, półtora ale kiedy przyszły kolejne projekty badawcze to wydatki wzrosły ok. x 1,5 (50% w stosunku do wartości projektów przy emisji). Nowe projekty były planowane do realizacji z dużym wyprzedzeniem, a na uzyskanie dofinansowania zakładano proceduralnie dłuższy okres, udało się je pozyskać w krótkim czasie już teraz.
Zgodnie z wypowiedziami przedstawicieli spółki mogliby się wstrzymać np.: do połowy roku 2020 i skoncentrować się tylko na uruchomionych już projektach, tym samym pokazać bardzo konkretnie co mają do komercjalizacji– projekty AptaPheresis i Multibody, ale to nie byłoby racjonalne i nie w interesie spółki i ich akcjonariuszy, żeby nie ruszyć do przodu z wszystkimi posiadanymi projektami. Dzięki temu nie będzie przestoju prac i wszystkie zespoły będą wydajnie pracować.
d) Ze względu na rozszerzenie portfela realizowanych projektów B+R Spółki, środki pozyskane z emisji akcji serii D (ostatnia emisja) przeznacza, jako wkład własny, na finansowanie realizacji:
• drugiego etapu projektu MultiBody o szacowanej wartości 6,1mln zł i z planowanym terminem realizacji II kw. 2020 roku,
• drugiego, trzeciego i części czwartego etapu projektu AptaPheresis o szacowanej wartości 3,9 mln zł i z planowanym terminem realizacji II kw. 2020 roku,
• pierwszego i części drugiego etapu projektu PureActivator o szacowanej wartości 5,4 mln zł i z planowanym terminem realizacji II kw. 2020 roku,
• części pierwszego etapu projektu PureBike o szacowanej wartości 3,2 mln zł z planowanym terminem realizacji II kw. 2020r
• pierwszego i części drugiego etapu projektu AptaMG o szacowanej wartości 2,7 mln zł i z planowanym terminem realizacji II kw. 2020 roku.
• trzeciego i ostatniego czwartego etapu projektu Pure Select2 o szacowanej wartości 1,6mln. zł i z planowanym terminem realizacji II kw.2020 roku,
• pierwszego etapu projektu AptaMLN o szacowanej wartości 0,6 mln zł z planowanym terminem realizacji II kw. 2020
e) Rzeczowe aktywa trwałe – wynosił na koniec II kw. 3 284,64 tys. zł jej główny składnik: „Inne środki trwałe” w kwocie 3 080,91 tys. zł ujmuje wartość aktywów informatycznych i wysoko zaawansowanych urządzeń laboratoryjnych służących do realizacji projektów B+R pozyskanych w formie długoterminowych umów i leasingu finansowego. Zwracam uwagę, że na 30.06 wartość ta wynosiła 1 917,85 tys. zł czyli wartość tej pozycji zwiększyła się w ciągu ostatnich 3 m-c o 1366,79 tys zł.
Wniosek- im więcej projektów badawczych tym więcej sprzętu i innych środków trwałych do realizacji tych projektów.
2. Opis zrealizowanych w III kw br prac najważniejszych dla spółki projektów Multibody i AptaPheresis, to one jako pierwsze mają największą szansę na komercjalizację. Jednak trzeba pamiętać, że równolegle (niektóre równie silnie) są też rozwijane inne projekty z pipeline spółki wymienione powyżej
Aby uniknąć przekłamań (opisy zakresu badań biotechnologicznych) zdecydowałem się na zacytowanie fragmentów raportu w tym zakresie. Wydaje się, że warto przytoczyć pełne fragmenty raportu, ponieważ opis jest bardzo obszerny i daje dość szerokie spojrzenie na postęp prac projektowych.
Multibody, obszar terapeutyczny- immunuonkologia, wskazanie rak jelita grubego i odbytu CRC
Dzięki wzmocnieniu kadry naukowej, możliwe było utworzenie dodatkowych przeciwciał oraz uzyskanie kolejnych potencjalnych kandydatów na leki, którzy wymagają przetestowania w układzie in vitro (układ komórkowy). W toku prac, poza uzyskaniem opisanego w projekcie schematu przeciwciała, otrzymano dwa dodatkowe przeciwciała, które służą jako podstawa do badań kombinacji przeciwciał. Daje to potencjalnie większą szansę na uzyskanie aktywnej biologicznie cząsteczki. Zaproponowane schematy przeciwciał z powodzeniem wytwarzane są w komórkowym systemie ekspresyjnym***, co pozwala na zwiększenie wydajności produkcyjnej. Ponadto opracowano protokół efektywnego oczyszczania cząsteczek z wykorzystaniem wewnętrznie zmodyfikowanej technologii. Dzięki temu rozwiązaniu wzrośnie efektywność otrzymywania cząsteczek o pożądanych cechach. Za pomocą kilku niezależnych podejść opracowano protokoły do testów cytotoksyczności in vitro. W najbliższym czasie w oparciu o testy in vitro firma przystąpi do istotnej fazy określania toksyczności kandydatów na leki w porównaniu do komercyjnie dostępnych przeciwciał. W ramach przygotowań do fazy przedklinicznej Zespól Badawczy, dzięki intensywnie prowadzonym analizom literaturowym oraz współpracy z konsultantami, członkami Rady Naukowej oraz nowozatrudnionymi ekspertami opracował dokładny plan eksperymentalny do walidacji przeciwciał w swoim laboratorium. Pierwotne podejście projektu zostało rozszerzone o kolejne doświadczenia. Krok ten pozwoli na dokładniejszą charakterystykę otrzymanych wariantów, a tym samym zwiększenie prawdopodobieństwa sukcesu kolejnych faz badawczych, w tym fazy badań in vivo (badań na modelu zwierzęcym). Pilotażowe badania na modelu zwierzęcym zrealizowane zostaną po zakończeniu badań in vitro, ze względu na zwiększenie panelu testów oraz dodanie kolejnych wariantów przeciwciał liczba testów znacząco wzrosła. Daje to możliwość szczegółowej analizy wszystkich cząsteczek oraz wyłonienie tych o najlepszych parametrach kinetycznych i farmakologicznych. W najbliższym czasie spółka zamierza zakończyć analizę biofizyczną cząsteczek aktywnych oraz wyłonić najbardziej obiecujących kandydatów na leki w wewnętrznych testach in vitro. Będzie to krok w kierunku rozpoczęcia wyboru wykonawcy do istotnej fazy testów in vivo. Ponadto, firma przygotowuje się do kompletowania dokumentów w celu uzyskania zgody na wstępne testy potencjalnych kandydatów na leki w modelu zwierzęcym (badania przedkliniczne). Ponownie przeprowadzono procedurę przetargową na wykonanie testów in vitro w zredukowanym w stosunku do oryginalnego zakresie merytorycznym. Wybrano te testy, których wykonanie jest konieczne poza siedzibą spółki ze względu na wymagania odnośnie poziomu bezpieczeństwa biologicznego. Oferta potencjalnego podwykonawcy nie spełniła wymagań projektowych. Spółka zamierza ogłosić kolejny przetarg uwzględniający dalej zredukowany zakres merytoryczny badań, niezbędnych do uzyskania informatywnych rezultatów.
Słownik:
*cel molekularny - makrocząsteczka zlokalizowana na komórkach układu immunologicznego i/lub komórkach nowotworowych, która oddziałuje z lekiem, co wywołuje pożądany efekt terapeutyczny,
**specyficzność - zdolność do wybiórczego rozpoznania i wiązania się z określoną makrocząsteczką (dopasowanie na zasadzie klucza i zamka),
***komórkowy system ekspresyjny - system produkcji przeciwciał w hodowlach komórek ssaczych.
Projekt PB002 (AptaPheresis)
Opracowywany w projekcie AptaPheresis wyrób medyczny pozwoli na prowadzenie terapii, która będzie pierwszym w klasie (ang. first-in-class) podejściem celującym w białka bezpośrednio wywołujące zmiany patologiczne u pacjentów cierpiących na Zespół Devica. Co ważne, na rynku nie istnieje bezpośrednie podejście konkurencyjne do leczenia tej choroby, którego wprowadzenie dodatkowo pochłaniałoby tak niewiele kosztów w stosunku do rozwoju klasycznej substancji farmakologicznie czynnej (leku).
W etapie nr 2 projektu AptaPheresis przeprowadzono łącznie 7 kampanii selekcji aptamerów wobec celu molekularnego, patogennego przeciwciała anty-AQP4. Biorąc pod uwagę wszystkie przeprowadzone selekcje, za pomocą algorytmów bioinformatycznych łącznie przeanalizowano setki milionów sekwencji aptamerów. Następnie wytypowane na podstawie tych analiz aptamery przetestowano pod kątem specyficzności wiązania do celu molekularnego selekcji. Do tego celu wykorzystano dwie techniki badawcze: test immunoenzymatyczny ELONA oraz analizę biofizyczną opartą o technikę interferometrii warstw biologicznych (ang. Bio-layer interferometry, BLI). W wyniku selekcji aptamerów oraz analizy wytypowanych klonów wybrano 6 aptamerów o najlepszych parametrach, które spełniają założone warunki i gotowe są do dalszej optymalizacji w etapie nr 3 projektu. Wyniki, które otrzymano (KD - stała dysocjacji w przedziale 22-156 nM) świadczą o wysokim powinowactwie (sile wiązania) aptamerów do przeciwciała anty-AQP4. W związku z powyższym kamień milowy etapu nr 2 został osiągnięty. W etapie nr 2 przetestowano również 3 różne złoża, na których zimmobilizowano aptamer (zakotwiczono do złoża testowego) oraz wykonano testy funkcjonalne. Przeprowadzone badania były eksperymentami pilotażowymi i miały za zadanie określić wstępny wybór złoża, które może posłużyć do budowy prototypu filtra opartego o aptamery. Wybrane złoża zgodnie z założeniami projektu charakteryzują się: dużą pojemnością, stabilnym wiązaniem, wysoką odpornością chemiczną i termiczną, jak również biokompatybilnością. W związku z tym, iż wyselekcjonowane aptamery wiążące przeciwciała anty-AQP4 są w fazie testów i optymalizacji, w celu wykonania testów funkcjonalnych zdecydowano się na użycie sprawdzonej modelowej sekwencji DNA rozpoznającej specyficznie swoisty cel molekularny. Do testów użyto szeroko opisywanego w literaturze aptameru HD-1, którego celem molekularnym jest trombina, białko powszechnie występujące w osoczu. Aptamer HD-1 jest jednym z najlepiej scharakteryzowanych aptamerów i w związku z tym stanowi modelową cząsteczkę stosowaną w badaniach . Aptamer HD-1 zimmobilizowano na złożach, a następnie przeprowadzono testy wiązania się celu molekularnego – trombiny – do złoża. Wiązanie trombiny było specyficzne dla każdego typu złoża, jednakże z różną wydajnością. W wyniku przeprowadzonych testów dokonano wyboru najwydajniejszego złoża, a także zoptymalizowano metodę immobilizacji aptameru na złożu w celu wydajnego wiązania celu molekularnego. Wyniki te stanowią podstawę do realizacji zadań w kolejnym etapie projektu. We wrześniu rozpoczęto realizację 3 etapu projektowego. Pierwszym zadaniem jest o optymalizacja wytypowanych w etapie 2 sekwencji aptamerów. W tym celu wybrano sekwencje najbardziej obiecujących aptamerów, które przeanalizowano pod kątem możliwości ich skrócenia. Zaprojektowano, a następnie zamówiono syntezę 4 skróconych lub zmodyfikowanych wersji dla każdego z trzech wybranych aptamerów. Aptamery w skróconych wersjach zostaną namnożone i poddane testom wiązania (test immunoenzymatyczny ELONA). Najbardziej obiecujące warianty zmodyfikowanych aptamerów zostaną poddane analizie z wykorzystaniem techniki BLI. W procedurze zgodnej z konkurencyjnością wyłoniony został Podwykonawca nr 2, który odpowiedzialny będzie za przygotowanie do wdrożenia systemu ISO-13485 (norma dot. wyrobów medycznych). Podsumowanie wyników W ramach etapu nr 2 zrealizowano wszystkie zaplanowane podzadania oraz osiągnięto założone kamienie milowe (1 - test oznaczania miana przeciwciał anty-AQP4 i 2 - wyselekcjonowanie min. 5 aptamerów wiążących przeciwciała anty-AQP4). Wyselekcjonowane aptamery (6 cząsteczek) posiadają odpowiednie parametry (Kd < 500 nM) i są gotowe do dalszej optymalizacji, testów stabilności nukleolitycznej oraz testów funkcjonalnych przewidzianych do realizacji w kolejnym etapie projektu. Spółka złożyła raport o zakończeniu realizacji etapu 2 do NCBR.
Słownik
*Aptamery - krótkie oligonukleotydy, fragmenty zbudowane z tego samego materiału co DNA – posiadające wysokie powinowactwo do wybranego celu molekularnego. Przypominają w bardzo wielu aspektach przeciwciała i mogą być zastosowane jako cząsteczki terapeutyczne i diagnostyczne.
**Afereza - procedura medyczna, podczas której krew pacjenta pompowana jest przez pozaustrojowe urządzenie, w którym – podobnie do dializy – następuje odseparowanie wybranych składników krwi i usunięcie ich, a „oczyszczona” w ten sposób krew wraca do krwioobiegu pacjenta. Od tego, jakiego rodzaju filtr znajduje się wewnątrz urządzenia do aferezy, zależy jakie substancje zostaną usunięte. Problematycznym aspektem tej terapii jest sposób selektywnego wyłapywania wybranych substancji – istniejące na rynku rozwiązania nie są w pełni specyficzne, przez co usuwane są nie tylko niepożądane w organizmie cząsteczki, ale również te, których obecność w krwi pacjenta jest pożądana, co prowadzi do, oprócz efektu leczniczego, istotnych działań niepożądanych.
3. Rozpoczęcie przygotowań do badań przedklinicznych
W ramach przygotowań i rozpoczęcia planowania prac obejmujących badania przedkliniczne spółka wzmocniła zespoły projektowe o ekspertów, którzy wesprą te działania swoimi kompetencjami. Rozróżniono dwa obszary :
a) obszar pierwszy obejmuje min. prace związane z przygotowaniem i planowaniem badań przedklinicznych, niezbędnych w ich realizacji protokołów badawczych oraz procedur kontrolnych i monitoringu wyników. Jednocześnie prowadzone będą działania zmierzające do identyfikacji i nawiązania współpracy z potencjalnymi wykonawcami certyfikowanych badań przedklinicznych w modelu zwierzęcym. Do realizacji tego celu powołano nowego menedżera badań przedklinicznych. Ekspert pochodzący z USA dołącza do zespołów projektowych w pełnym wymiarze zaangażowania. Jak podaje spółka posiada on rozległe doświadczenie w planowaniu, prowadzeniu i zarządzaniu badaniami na zwierzętach.
b) obszar drugi , niezbędny do prawidłowego przygotowania badania przedklinicznego, obejmuje prace związane z opracowaniem dokumentacji badań, utrzymaniem standardów oraz procedur wymaganych przez agencje regulatorowe udzielające pozwoleń na prowadzenie badań przedklinicznych. Spółka pozyskała konsultantkę ds. regulatorowych, doświadczoną menedżer z rozległą wiedzą w zakresie legislacyjno-regulacyjnym w procesie rozwoju produktów farmaceutycznych i żywieniowych. Wg. przedstawicieli spółki jej szerokie kompetencje, zdobyte w takich firmach jak np. Elanco/Eli Lilly, pozwalają na skuteczne pokonywanie barier związanych z przygotowaniem i składaniem dossier dokumentów dot. kandydatów na lek w takich agencjach jak EMA, FDA czy EFSA.
4. Zakończenie procesu budowania zaplecza naukowo badawczego i laboratorium B+R
Realizacja projektów B+R w Spółce opiera się na współpracy Zespołów Naukowych i Grup Badawczych z Naukowymi Kierownikami Projektów. Jak podaje spółka przyjęcie takiego rozwiązania pozwala na optymalne wykorzystanie zasobów naukowych, koncentracji wiedzy i doświadczenia
Zespoły Projektowe odpowiadają za realizację założeń naukowych i celów projektowych we wszystkich etapach projektów. Są one dedykowane do poszczególnych projektów lekowych i terapeutycznych prowadzonych przez Spółkę. W zespołach tych Naukowy Kierownik Projektu - doświadczony naukowiec z ekspertyzą w obszarze projektu - ustala cele i zapewnia szerszą perspektywę oraz zarządza rozdziałem zadań pomiędzy Grupy Badawcze odpowiedzialne za merytoryczną jakość realizowanych badań. Grupy Badawcze odpowiadają za realizację eksperymentów zaplanowanych w toku trwania każdego projektu. Grupy te cechują się doświadczeniem w swoim konkretnym obszarze działań. Decydują one o planie i wykonaniu konkretnego eksperymentu, sugerują najlepsze metody analizy i zapewniając wysoką jakość naukową wyników popartą specjalistycznym doświadczeniem.
W Pure Biologics działa sześć grup badawczych : Grupa Biologii Molekularnej, Grupa Inżynierii Białek, Grupa Przeciwciał (AB), Grupa Aptamerów (AM), Grupa Biologii Komórki (CB), Grupa Biofizyczna
5. Modyfikacja podejścia Spółki do formy realizacji i sposobu finansowania projektów diagnostycznych
Projekty B+R z obszaru diagnostyki realizowane będą głownie w oparciu o współpracę z wytypowanymi Partnerami Branżowymi i finansowane ze środków opartych o zawarte umowy partnerskie lub w układzie konsorcjalnym z Partnerem Branżowym. Wg. spółki przyjęcie takiego rozwiązania zwiększy prawdopodobieństwo komercjalizacji przez podmioty branżowe funkcjonujące w sektorze wyrobów diagnostycznych, obniży koszty realizacji projektu w fazie rozwojowej (wykorzystanie doświadczeń i zaplecza partnera branżowego) oraz zapewni racjonalne wykorzystanie środków finansowych przez obie strony projektu. Obecnie Spółka pracuje nad możliwością prowadzenia wspólnych projektów z potencjalnym Partnerem Branżowym.
Wniosek- trudno mi się nie zgodzić ze sposobem myślenia spółki. Każdy robi to na czym się zna najlepiej, spółka posiada kompetencje w zakresie przeciwciał i aptamerów, czyli potrafi dostarczyć znakomity „silnik” do urządzenia diagnostycznego, które powinien zaprojektować i testować podmiot wyspecjalizowany, zajmujący się tym na co dzień.
6.Podsumowanie
Finanse – spółka konsekwentnie zwiększa zmianę stanu produktów, która przedstawia w zasadniczej części nakłady poniesione na prace badawczo-rozwojowe. Przychody netto ze sprzedaży badan kontraktowych są niższe m.in. z powodu przesunięcia części osobowych zasobów naukowo badawczych wyłącznie do przygotowania własnych projektów B+R które stanowią o wartości spółki obecnie a przede wszystkim w przyszłości. Środki pieniężne czyli cash is king- na koniec okresu III kw wynosiły 4,3 mln zł, w tym kw. wydane zostało ok. 2 mln zł ( uwzględniając środki obrotowe, które Spółka wykorzystuje do finansowania comiesięcznych całkowitych kosztów projektowych , które czekają prze okres 2-3 miesięcy na rozliczenie z NCBR) musi nastąpić w I/II kw2020r. Spółka wydaje o 50% więcej niż pierwotnie zakładano przy ostatniej emisji ponieważ w międzyczasie wprowadziła kolejne projekty, które zwiększają jej szansę na sukces komercyjny. Rzeczowe aktywa trwałe – zwiększyła się w ciągu ostatnich 3 m-c o 1,4 ml zł to przede wszystkim wartość aktywów informatycznych i wysoko zaawansowanych urządzeń laboratoryjnych służących do realizacji projektów B+R pozyskanych w formie długoterminowych umów i leasingu finansowego - czyli im więcej projektów badawczych tym więcej sprzętu i innych środków trwałych do realizacji tych projektów.
Kluczowy projekt - Multibody spółka wzmocniła zespół, prace idą swoim torem, są tak planowane aby dać jak najwięcej szans na pozytywny przebieg najważniejszych testów czyli testów przedklinicznych. Wstępnie przebadani zostaną kandydaci na leki na małej partii modelu zwierzęcego. Wydaje się, iż przyjęte podejście aby wstępnie przebadać cząstki na modelu zwierzęcym przed wysłaniem do badań przedklinicznych, jest bardzo dobre bo zwiększa szanse na sukces. Trzeba też pamiętać, że zewnętrzne badania kosztują a gdyby coś nie wyszło trzeba się cofać do laboratorium a jedocześnie czekać na wolne moce przerobowe zewnętrznego laboratorium do kolejnej próby co trwa i kosztuje. Spółka przygotowuje się do fazy przedklinicznej zatrudniając w tym celu wysokiej klasy specjalistów : naukowca od przedkliniki z doświadczeniem do planowania i nadzoru – fulltime oraz konsultanta od procedur i dokumentów. Projekt AptaPheresis – spółka posiada już kandydatów na cząsteczki aktywne biofiltra, wybrała złoże do urządzenia diagnostycznego, przystąpiła do testów fazy nr3.
Zmiany organizacyjne - nie jestem specjalistą od badań laboratoryjnych ale wydaje się, że organizacyjnie w przyjętym systemie każdy robi to co umie najlepiej. Jest grupa innowatorów czyli zespół projektowy, którzy prowadzą dany projekt od początku do końca, są grupy badawcze wykonujące w zakresie swoich najlepszych kompetencji otrzymane zadania od zespołów projektowych.
Na koniec ryzyka – czy są ?, oczywiście, że tak, wszystkie cały czas aktualne to biotechnologia oraz programy badawcze dlatego ryzyka oczywiście istnieją, najważniejsze z nich : posypanie się badań, brak finansowania lub odejście kluczowych osób. Ale w moim przekonaniu, jak w każdym biznesie, również w takim- im więcej działań profesjonalnych, logicznych, zgodnych ze sztuką zarządzania ryzykiem tym większa szansa na sukces, a te działania są dla mnie tutaj bardzo widoczne.
|
|
Temat:
PURE
Czytając komunikaty widzę, na walnym nie będzie nic nadzwyczajnego
Ad4 - Wybór członka Rady Nadzorczej
Ad 5 – zmiana statutu spółki zamiana akcji uprzywilejowanych a akcje zwykłe
Ad6 –na kolejne 3 lata udzielenie nowego upoważnienie zarządowi do podwyższenia kapitału docelowego (czytaj przeprowadzenia emisji akcji) w formie identycznej jak to było w poprzednim upoważnieniu.
|
|
Temat:
SCPFL
To oczywiście znakomita informacja, oznacza ona, że Bacteromic działa porównywalnie z konkurentem Vitek 2 a zostało to przetestowane przez zewnętrzne laboratorium w docelowym środowisku klinicznym. Potwierdza to w pełni wstępne zapowiedzi spółki, że uzyskane wyniki potwierdzają unikalną dla systemu BacterOMIC, ofertę analizy synergii pomiędzy wieloma parami antybiotyków w automatycznym teście. Poza tą prewalidacją kliniczna, która zakończyła się w Instytucie Gruźlicy i chorób Płuc w Warszawie równolegle jest prowadzona w Szpitalu Qeen Mary University w Londynie, pewnie niedługo będziemy wiedzieć o wynikach.
Co mi się najbardziej w spółce podoba ? że co zapowiada to robi, jest plan i go konsekwentnie realizuje. A po drugie, wyniki uzyskane w laboratoriach zewnętrznych oraz feedback użytkujących go osób, są bardzo skrupulatnie i z sukcesem wykorzystywane do poprawienia zarówno uzyskiwanych parametrów jak i ergonomii urządzeń (tak jest obecnie z Bacteromicem oraz tak było z PCRone)
|
|
Temat:
SCPFL
Total zwiększy swoje udziały
Zostaną wyemitowane akcje serii F na rzecz Total Fiz (największego akcjonariusza w spółce) w ilości nie większej niż 231540 akcji, przy czym Total Fiz sprzeda do rynku 170772 akcji za cenę nie wyższą niż 70 zł. Cena sprzedaży i nabycia akcji przez Total Fiz będą równe.
To oznacza, że np: w przypadku ceny 70 zł, Total dokupuje 60768 akcji (231540-170772)= za 4,2 ml, czyli z emisji 16,2 mln bierze te 4,2 mln. W przypadku niższej ceny wartości te są mniejsze ale udział procentowy Totala w emisji bz.
|
|
Temat:
SCPFL
Też o ten slajd pytałem. Moim zdaniem temat jest następujący : certyfikacja i rejestracja połowa 2020, a ew. negocjacje i sprzedaż , może faktycznie tak jak pokazuje praktyka rynkowa kilka dni po, a może kilka m-cy po tej certyfikacji jeśli określone działania wniosły by element cenotwórczy do negocjacji. Dlatego część działań z buforem czasowym przeciągnięta jest do końca roku.
|
|
Temat:
SCPFL
Analiza spółki Scope Fluidics
18.11.2019r
Poniżej całościowa analiza spółki Scope Fluidics. Jak zwykle zastrzegam, iż to wyłącznie moje spojrzenie na tę spółkę, a wiec oczywiście miejscami mogę być subiektywny, mogę się mylić , ale po to piszę te analizę jak i wszystkie inne, aby zobaczyć uwagi i punkt widzenia innych inwestorów na podane fakty i wyciągnięte wnioski.
Zaznaczam też, nie przedstawiam spółki zupełnie od początku, ale same najważniejsze elementy części biznesu dla tych inwestorów, którzy spółkę obserwują i się nią interesują. W którym miejscu są, co już zdołali zrobić, do czego dążą i jakie po drodze są ryzyka inwestycyjne. To tekst napisany przez inwestora dla inwestorów w celu lepszego zrozumienia specyfiki spółki, startupu pracującego w trudnej dla laika branży urządzeń analityki diagnostycznej a co za tym idzie dokonania własnego podsumowania analitycznego.
1) Realizowane projekty- czyli co spółka tworzy
Spółka tworzy innowacyjne systemy diagnostyczne odpowiadające na największe potrzeby na rynku globalnym. W modelu biznesowym Spółki Scope Fludics są dwie jednostki zależne – Curiosity Diagnostics sp. z o.o. (tworząca system PCRONE) oraz Bacteromic sp. Zo.o. (tworząca system BacterOMIC). Te dwa systemy stanowią o wartości spółki, ponieważ w założeniu po certyfikacji i rejestracji mają zostać sprzedane wraz z spółką zależną do potencjalnego nabywcy.
System PCRONE
System PCR|ONE jest wszechstronną platformą do badań polegających na wykrywaniu w materiale genetycznym człowieka (np.: w ślinie) patogenów czyli wirusów oraz bakterii. W chwili obecnej spółka przygotowała kartidż (specjalny panel do wykrywania pojedynczego patogenu oraz równocześnie tzw. genów odporności) dla MRSA czyli rodzaju bardzo odpornego gronkowca oraz panel wykrywający zakażenie groźną bakterią Clostridium difficile. Planowany jest też rozwój paneli diagnozujących zakażenie grypą oraz niebezpiecznymi bakteriami gram ujemnymi opornymi na antybiotyki. Te ostatnie dwa panele na poziomie potwierdzonych testów wewnętrznych mają być gotowe do połowy 2020r.
Dlaczego właśnie PCRONE oraz dlaczego takie panele ?
Koszty leczenia każdej z bakterii (MRSA, Clostridium difficile, grypa, bakterie gram ujemne) sięgają tylko w samym USA kilka mld usd rocznie, liczba hospitalizowanych osób to setki mln a śmierć ponosi kilkadziesiąt tysięcy osób rocznie. Oczywistym jest, że łatwa i szybka diagnostyka tych bakterii to możliwość ich szybszego wyleczenia. Co równie ważne diagnostyka tzw. point of care (np.: przy przyjęciach do szpitali) umożliwia skierowanie na konkretny oddział szpitalny jedynie osoby nie zakażonych takimi bakteriami a wiec nie dopuszczając dalszego rozpowszechniania się zakażenia. Przy 15 lub 20 min. badaniu to zupełnie realne, ponieważ czas odgrywa tutaj kluczowy element. Osoby zakażone mogą być skierowane na specjalistyczny oddział leczący a po wyleczeniu przejść do docelowego oddziału szpitalnego. Dzisiejszą codzienność zamykania oddziałów szpitalnych z powodu rozpowszechniania się danej groźnej bakterii można bardzo łatwo ograniczyć poprzez szybką diagnostykę taką właśnie jak oferuje PCRONE.
Konkurenci na rynku a PCRONE
Na rynku dostępnych jest siedem systemów wykonujących podobna diagnostykę jak PCRONE, jednak każdy z nich wykorzystywany jest do innego celu i charakteryzuje się różnymi parametrami. Najważniejsze parametry to ilość genów do zidentyfikowaniu w poj. badaniu oraz czas badania. Są systemy mogące identyfikować do 48 genów ale przy czasie badani 90 min, oraz 2 geny w czasie 20 min. Dlatego też bezpośrednią konkurencją dla PCRONE są systemy szybkie, które w chwili obecnej oferują niewielką ilość badanych genów, czyli dostarczają niewielką ilość informacji lekarzowi do identyfikacji zagrożenia. Wśród aparatów oferujących kompleksowe badanie PCRONE jest najszybszy, porównywany się do czasów konkurencji na poziomie co najmniej godziny
Podsumowując - przewaga PCRONE to trzy aspekty - rekordowo krótki czas (15-20 min), mnogość genów wykrywanych w pojedynczym badaniu oraz dodatkowy, niezwykle ważny element łatwość modyfikacji panelu genów w przyszłości, w odpowiedzi na zmieniające się wyzwania epidemiologiczne
Przewidywana cena aparatu i używanych kartidży
W dzisiejszym świecie diagnostyki model biznesowy wykorzystania tego rodzaju urządzeń bardzo często polega na wypożyczeniu urządzenia za niewielką kwotę nawet 1 $ miesięcznie aby zysk realizować ze sprzedaży kartiżdy wiec to one są najważniejszym elementem ekonomii. Kartiżdże do PCRONE były od początku tak projektowane aby ich cena sprzedaży była bardzo konkurencyjna, nawet przy przewidywanym spadku cen obecnych testów konkurencji.
Na jakim etapie jest PCRONE ?
Można powiedzieć na ostatniej prostej : przeprowadzono serię testów prewalidacyjnych systemu PCR|ONE przez certyfikowaną pracownię mikrobiologiczną, należącą do ALAB laboratoria, jednej z największych ogólnopolskich sieci laboratoriów diagnostycznych. Badania polegały na przeprowadzeniu testów z wymazów nosowych pacjentów, pod kątem obecności gronkowca złocistego oraz jego lekoopornych wariantów. Testy wykonywane były na systemie PCR|ONE, oraz tradycyjną metodą hodowli bakterii na szalkach i z systemu GeneXpert, który jest obecny na rynku od 2006 roku i stanowi bezpośrednie odniesienie konkurencyjne dla systemu PCR|ONE. Uzyskane wyniki potwierdziły skuteczność kliniczną systemu PCR|ONE, z parametrami oznaczenia podobnymi do standardów rynkowych i w zakresie wymagań klinicznych.
Co teraz ?
Do końca roku planowane jest uruchomienie pilotażowej linii produkcyjnej (na potrzeby cerytyfikacji PCRone oraz panelu MRSA). Rejestracja i certyfikacja (europejska CE-IVD), deklarowana przez spółkę to czas do końca połowy 2020r
System BacterOMIC
Projekt BacterOMIC ma stanowić odpowiedź na rosnące zjawisko antybiotykoodporności bakterii i zwiększyć skuteczność leczenia pacjentów, poprzez wskazywanie najlepszych dla danego pacjenta terapii celowanych. Najprościej mówiąc system wykonuje automatyczny antybiogram tj. oznacza, jaki antybiotyk skutecznie leczy dowolne zakażenie bakteryjne człowieka.
Odporność bakterii na działanie antybiotyków staje się coraz poważniejszym wyzwaniem. Już dziś w Europie 70 proc. zakażeń jest oporna na co najmniej jeden antybiotyk. Według szacunków Światowej Organizacji Zdrowia (WHO) lekooporne bakterie w ciągu najbliższych 35 lat mogą doprowadzić na świecie do śmierci nawet 300 milionów ludzi, co sprawia, że są one najważniejszym zagrożeniem dla zdrowie publicznego.
Co oczywiste lekarz nie widzi groźnej bakterii w ciele człowieka i aby ją skutecznie leczyć musi wiedzieć na co ona reaguje oraz jaka jest tzw. graniczna min dawka skutecznego antybiotyku. W standardowym antybiogramie (czasochłonnym, robionym w rzeczywistości bardzo rzadko, na małej ilości dostępnych antybiotyków) lekarz otrzymuje podstawowe informacje – patogen odporny lub nie na dany antybiotyk. To oczywiście zbyt mała ilość informacji. W BacterOmic testowane są wszystkie dostępne kliniczne antybiotyki a jeśli to nie zda rezultatu to dodatkowo ich 20 kombinacji. Projekt ten ma szansę być pierwszym na świcie automatycznym systemem diagnostycznym umożliwiającym badanie kombinacji antybiotyków w przypadkach najtrudniejszych zakażeń, w których żadne antybiotyki podawane pojedynczo, nie są skuteczne.
Bacteromic sp. z o.o. pozyskał pozytywną rekomendację do dofinansowania w ramach europejskiego programu Horyzont 2020 w kwocie 1,93 mln EUR na rozwój systemu BacterOMIC. Warto o tym wspomnieć, ponieważ to bardzo prestiżowy grant, poza samymi pieniędzmi niosący dla potencjalnych nabywców informację o jakości oferowanego systemu. Niewiele firm w Polsce udało się taki grant pozyskać.
Konkurenci na rynku a Bacteromic
Największy konkurent to urządzenie Vitec 2 – czas analizy jest podobny ale ilość informacji jest o wiele mniejsza a to element krytyczny. Panel Bacteromic jest przygotowywany w cenie panelu konkurenta przy o wiele większej gęstości informacji. Cena panelu oraz mnogość informacji dla lekarza, jest tutaj najważniejsza, ponieważ podobnie jak w przypadku PCRone model biznesowy będzie polegał na wypożyczeniu urządzenia za niewielką kwotę aby zysk realizować ze sprzedaży paneli.
Na jakim etapie jest Bacteromic ?
Na początek warto przypomnieć, ze spółka na początku tego roku ogłosiła skrócenie pierwotnego harmonogramu dla Bacteromic o 12-18 m-cy.
Co do tej pory zostało zrobione : potwierdzone zostało działanie systemu w testach przeprowadzonych pod koniec 2018r w laboratoriach Narodowego Instytutu Leków. Obecnie w systemie systematycznie rozszerzana jest lista na panelu antybiotyków i tzw. panelu synergy (kombinacji antybiotyków). Trwa też tzw. prewalidacja kliniczna w Instytucie Gruźlicy i chorób Płuc w Warszawie oraz w Szpitalu Qeen Mary University w Londynie. Uzyskane wyniki potwierdzają unikalną dla systemu BacterOMIC, ofertę analizy synergii pomiędzy wieloma parami antybiotyków w automatycznym teście. Spółka ma nadzieję jeszcze w tym roku raportować wyniki. Ponadto w tej chwili kończone są prace analizatora i paneli w wersji produkcyjnej.
Co teraz?
W pierwszej połowie 2020r planowana jest gotowość do badań przedrejestracyjnych a w II połowie 2020 roku planowane jest przeprowadzenie tych badań. Do końca drugiego kwartału 2021 planowana jest rejestracja i certyfikacja europejska CE-IVG.
2) PCR|ONE i BacterOMIC na 71 edycji AACC Annual Scientific Meeting, największych na świecie targów i konferencji diagnostycznej, w sierpniu 2019r w Kalifornii w USA
Systemy realizowane przez firmę znalazły się wśród siedmiu przełomowych rozwiązań medycznych z całego świata, na dorocznych targach i konferencji organizowanego przez American Association for Clinical Chemistry (AACC), największej na świecie organizacji skupiającej specjalistów diagnostyki medycznej. Spółka weszła do wąskiego grona półfinalistów co zagwarantowało im prezentację systemów PCR|ONE i BacterOMIC na własnych stoiskach w strefie AACC’s Innovation Zone podczas targów. W konferencji i targach AACC brało udział ponad 20 tysięcy przedstawicieli firm i laboratoriów diagnostycznych. Sama organizacja AACC skupia 50 tysięcy specjalistów diagnostyki medycznej, lekarzy, naukowców oraz liderów firm diagnostycznych z całego świata i działa na rzecz rozwoju metod diagnostyki medycznej – diagnostyki molekularnej, chemii klinicznej, spektrometrii masowej i medycyny precyzyjnej. AACC jest również wydawcą Clinical Chemistry - najważniejszego periodyku naukowego w dziedzinie diagnostyki medycznej.
Wg, relacji przedstawicieli spółki w czasie targów odbyli mnóstwo spotkań i nawiązali różnego rodzaju kontakty. Firma doradcza Clarifiel była obecna w ciągu całego czasu trwania targów i aktywnie pracowała wraz z przedstawicielami spółki w spotkaniach jako budowaniu podstaw przyszłych kontraktów. Tego rodzaju proces to zazwyczaj wielomiesięczne rozmowy i sprawdzanie wiarygodności startupu. Tą wiarygodność dla firmy budował m.in. Cleirfield, prof. Carl Wittwer (był obecny na targach, uczestniczył w niektórych rozmowach spółki, prowadził wykłady), uzyskany przez spółkę grant programu europejskiego Horyzont 2020, nagroda AACC itp. Jak wspominali przedstawiciele spółki, byli oni bardzo dobrze przygotowani do targów i mieli świadomość ich przełomowego charakteru dla rozwijanych projektów, dlatego wykorzystali je najlepiej i najbardziej profesjonalnie jak tylko mogli.
Podsumowując- systemy rozwijane przez spółkę znalazły się wśród siedmiu przełomowych rozwiązań medycznych z całego świata, na dorocznych targach i konferencji organizowanego przez American Association for Clinical Chemistry (AACC) i doszły do półfinału konkurs. To wielki sukces, którego nie osiągnęła żadna znana mi polska firma. Poza sukcesem i splendorem to znakomita okazja do pokazania się, uwiarygodnienia i rozpoczęcia wstępnych rozmów z potencjalnymi nabywcami na temat sprzedaży rozwijanych przez spółkę systemów diagnostycznych i te działania spółka konsekwentnie rozwijała.
3) Monitoring podobnych systemów diagnostycznych na rynku, na targach AACC oraz ryzyko pojawienia się nowego gracza
Wg. przedstawicieli spółki na targach AACC w Kalifornii były inne podobne systemy (urządzenia zbliżone do PCRone) ale wg. dr Kamila Gewartowskiego (kierownika projektu PCRone) ewidentnie gorsze, w tym jeden równie szybki ale dwa lata za nimi pod względem technicznym. Spółka oczywiście wie, że ktoś się może pojawić i nie wyklucza tego, ale ryzyko szacuje jako niewielkie biorąc pod uwagę znajomość rynku oraz na bieżąco monitorując zgłoszenia patentowe. Przeciętne wprowadzenie urządzenia na rynek to 8 lata, raczej nie ma szans aby ktoś nagle się pojawił z czymś gotowym.
Bacteromic- na targach nic podobnego nie było, jak mówili przedstawiciele spółki rynek w zakresie tych urządzeń jest o wiele mniej płynny (nie ma wielu takich urządzeń na świecie).
4) List intencyjny spółki AstraZeneca Pharma Poland sp. z o.o.
AstraZeneca Pharma Poland sp. z o.o. jest zainteresowana wsparciem procesu rozwoju systemu BacterOMIC. W Liście intencyjnym AstraZeneca Poland poinformowała, że postrzega system BacterOMIC (biorąc pod uwagę stosowane rozwiązania wykorzystujące technologię mikroprzepływów) jako idealne narzędzie do pomocy przy rozwoju nowych leków lub ich kombinacji. AstraZeneca Poland widzi również zastosowanie systemu BacterOMIC do automatycznego testowania nowych leków wprowadzanych na rynek.
Zgodnie z Listem, AstraZeneca Poland deklaruje wsparcie w następujących obszarach:
- konsultacje kompozycji anytbiotyków na panelu BacterOMIC oraz
- testowanie systemu BacterOMIC pod kątem zastosowania go do rozwoju leków (zakładając stosowną funkcjonalność systemu).
List intencyjny AstraZenca Pharma, jednej z największych firm farmaceutycznych na świecie nie jest oczywiście żadną umową, ale może wyznaczać wartość dodaną do systemu w obszarach, które do tej pory były nierozpoznane biznesowo.
5) Ochrona patentowa
Wg. przedstawicieli spółki posiada ona starannie planowaną i zarządzaną strategię budowania ochrony patentowej, oba projekty są już chronione zgłoszeniami patentowymi i przyznanymi patentami. Dla przykładu - kluczowy moduł systemu PCR|ONE odpowiedzialny za ultra-szybki PCR oraz detekcję ma już przyznany patent w USA, a procesy biegną równieź w Europie oraz w Chinach.
W ostatnich miesiącach spółka pozyskała dodatkowe finansowanie na ochronę patentową rozwiązań w systemie Bacteromic (komunikat z 28.10.) i w systemie PCR|ONE (komunikat z 19.09).
6) Renomowany doradca
Doradcą spółki jest firma Clairfield -firma znalazła się w pierwszej dziesiątce doradców finansowych w Europie. Realizują średnie transakcje do 500 mln eur, w 2017 brała udział w 110 procesach. Firma Clairfield zajmuje wysokie miejsca w rankingach największych firm doradczych realizując dużo transakcji ale najlepsze miejsca zajmuje w małych i średnich firmach i w tym się specjalizuje.
Clairfield International opublikowało "Clairfield’s Annual Outlook 2019 examines leading themes in business and finance". Wśród kilku rozmówców z całego świata, z różnych dziedzin jest Szymon Ruta, członek zarządu odpowiedzialny za kwestie finansowe w Scope Fluidics. Wywiad z nim jest opublikowany jako jedyny w sektorze Healthcare. To, moim zdaniem, wielkie wyróżnienie aby wśród setek tematów, które na całym świecie prowadzi tak doświadczony doradca jak Clairfield wybrać właśnie przedstawiciela Scope Fluidics a zarazem potwierdzenie tego, że widzą w Scope Fluidics potencjał i wiążą z nim wielkie nadzieje.
Jak oświadczają przedstawiciele spółki wynagrodzenie Clairfield oparte jest głównie na tzw. succcess fee, czyli premii od osiągniętej ceny sprzedaży systemów. Ponadto wynagrodzenie to ma poziom rynkowy a doradcę transakcyjnego wybrali w starannym procesie kwalifikacji, w szczególności biorąc pod uwagę doświadczenia w realizacji kontraktów M&A na rynku medtech, głównie z perspektywy wysokiego prawdopodobieństwa sprzedaży systemu PCRIONE.
7) Zespół tworzący systemy
Scope Fluidics to 40 specjalistów reprezentujących pełną interdyscyplinarność, konieczną to tworzenia innowacyjnych systemów diagnostycznych.
Moim zdaniem - ludzie i jeszcze raz ludzie to oni decydują o prawdopodobnym sukcesie lub porażce w każdym biznesie a startupach jest to ważne szczególnie. To dla mnie argument nr 1 decydujący o tym czy coś z tego wyjdzie czy też nie.
Prof. Piotr Garstecki - „ludzie to podstawowa wartość tej spółki”
Zarząd spółki tworzy
-prof. Piotr Garstecki - współautor ponad stu publikacji naukowych i ponad stu zgłoszeń patentowych, prowadził projekty naukowe i techniczne w Polsce i w Stanach Zjednoczonych na Uniwersytecie Harvarda. Od 2014 roku profesor zwyczajny.
-Marcin Izydorzak- współzałożyciel Scope Fluidics. Posiada 15-letnie doświadczenie w zarządzaniu zespołami badawczo-rozwojowymi w spółkach technologicznych, instytutach naukowych oraz firmach farmaceutycznych. Był odpowiedzialny za szereg wdrożonych na rynek produktów farmaceutycznych.
-dyr. Finansowy Szymon Ruta Menadżer z ponad 15-letnim doświadczeniem w realizacji projektów fuzji i przejęć, inwestycji i restrukturyzacji. Pełnił funkcje członka zarządu oraz zasiadał w radach nadzorczych podmiotów notowanych na Giełdzie Papierów Wartościowych. Zarządzał funduszem o wartości 125 mln EUR.
Kilkakrotnie miałem przyjemność być w spółce, rozmawiać z zarządem, zwiedzać laboratoria. Wywarło to na mnie bardzo dobre wrażenie, to znakomici fachowcy, którzy wiedzą co robią. Prof. Garstecki to bardzo otwarty naukowiec, który jednocześnie dobrze zna i rozumie biznes wyznający zasadę „najpierw identyfikacja problemu, następnie możliwość rozwiązania i opłacalność biznesowa, potem kontakt się z biznesem”. Marcin Izydorzak (pracował w spółce Adamed) przekłada pomysły na praktykę i linię przemysłową. Szymon Ruta dyr. finansowy, bardzo dobrze porusza się po rynku finansowym. Dr Kamil Gewartowski – szef programu PCRONE, dr Seweryn Bajer-Borstyn – szef programu Bacteromic i inni
Nie sposób wszystkich wymienić, ale jeśli rozmawiamy o sukcesie lub jego braku w kategoriach prawdopodobieństwa, to taki zespół ludzi ma bardzo duże prawdopodobieństwo doprowadzić do końca projekty które realizuje.
8) Komitet Doradczy Scope Fluidics
Składa się z międzynarodowych autorytetów o zróżnicowanych kompetencjach i doświadczeniach.
Dr David Wareham - światowej klasy mikrobiolog kliniczny z renomowanego londyńskiego Uniwersytetu Queen Mary i największego w Londynie laboratorium mikrobiologicznego, posiadający ogromne doświadczenie w diagnostyce, leczeniu oraz badaniach naukowych nad zakażeniami bakteryjnymi. Jak mówi prof. Piotr Garstecki „David jest dla nas źródłem trudno dostępnych informacji wykorzystywanych przez nas w prowadzonych eksperymentach mikrobiologicznych i biochemicznych”.
Sarai Kemp - izraelska specjalistka w dziedzinie rozwoju startupów w obszarze biotechnologii i life sciences. Sarai dzięki kompetencjom stricte finansowym uzupełnia rolę Komitetu o aspekty w pozyskiwaniu finansowania, komercjalizacji i sprzedaży projektów oraz prowadzeniu startupów w środowisku międzynarodowym.
Dr Vincet Linder - założyciel Claros Diagnostics sprzedanej za 50 mln USD. autor ponad 300 patentów w zakresie technik mikroprzepływowych i diagnostyki przyłóżkowej. Doświadczenie min. w procesie proces certyfikacji europejskiej urządzeń diagnostycznych CE-MARK
dr Agnieszka Sulikowska –uznany specjalista w zakresie zakażeń szpitalnych. Konsultant mikrobiologii klinicznej i kontroli zakażeń szpitalnych.
prof. David Weitz –Profesor fizyki na Universytecie Harvarda, jest jednym z najczęściej cytowanych fizyków na świecie, zajmuje się fizyką miękkiej materii, polimerami oraz mikrofluidyką. Stworzył wiele nowoczesnych technologii, w tym istotnie przyczynił się do stworzenia technologii sekwencjonowania pojedynczych komórek. Ma wieloletnie doświadczenie w pracy dla przemysłu oraz w środowisku akademickim. Zasiadał w radach doradczych wielu firm przemysłowych, jest współzałożycielem 20 startupów technologicznych, w tym w obszarze life sciences oraz diagnostyki medycznej. W szczególności wesprze Spółkę swoim doświadczeniem zakresie tworzenia rewolucyjnych rozwiązań w sektorze lifescience i technik mikroprzepływowych.
Prof. Piotr Garstecki „Konsekwentnie staramy się doskonalić wiedzę i kompetencje nt. światowych standardów w diagnostyce medycznej. Zaangażowanie tak doświadczonych specjalistów i naukowców, którzy obecnie zasiadają w Komitecie Doradczym, znacząco zwiększają szanse na realizację strategicznych planów komercyjnych naszych projektów”
„Nie przewidujemy wynagrodzenia z tytułu powołania do komitetu doradczego. Są to nasi ambasadorowie, którzy pełnią tą funkcję honorowo. dla tych osób wartością jest wspieranie technologii o istotnej wartości dla diagnostyki medycznej, nie tylko z perspektywy wycen finansowych, ale również aspektów społecznych”
9) Co uznane autorytety mówią o kompetencjach spółki i rozwijanych przez nie systemach ?
- prof. Carla Wittwer - amerykański profesor, który w latach 90-tych opracował pierwszy system do prowadzenia reakcji PCR w czasie poniżej godziny. Był to pierwszy system do oznaczania ilości materiału genetycznego. Założyciel firmy Biofire Diagnostics opracował również system do diagnostyki medycznej - FilmArray, który został przejęty w 2014 r. przez koncern Bio Merieux za 450 mln USD.
prof. Piotr Garstecki : „Prof. Wittwer jest jednym z najważniejszych autorytetów w obszarze technologii diagnostyki molekularnej, nadal aktywnie prowadzi badania, wykłada i komentuje rozwój technologii w tym obszarze.- Na świecie jest kilku naukowców, którzy tak dobrze znają technologię PCR. To osoba, która w tym obszarze nie pozostawia żadnych pytań bez odpowiedzi. Wsparcie prof. Wittwer’a jest dla nas ogromnym wyróżnieniem i z pewnością będzie ułatwiało wprowadzanie systemu PCR|ONE na rynek”
prof. Carla Wittwera „PCR|ONE to unikalne rozwiązanie znajdujące zastosowanie w monitorowaniu zakażeń szpitalnych. To bardzo szybka technologia realizująca ekstremalna reakcję PCR, amplifikację w czasie rzeczywistym i analizę topnienia w celu wykrycia niebezpiecznych szczepów bakterii znacznie szybciej niż jakakolwiek inna dostępna technologia. Jej ogromną zaletą jest również bardzo niski koszt przeprowadzenia badania”
- Prof. David Weitz jest jednym z czołowych autorytetów w dziedzinie technik mikroprzeplywowych oraz miękkiej materii oraz bioinżynierii. Jest jednym z najczęściej cytowanych fizyków na świecie
Prof. David Weitz : „Jestem pod ogromnym wrażeniem. Spotkałem tu bardzo dobry zespół, ze wszystkimi potrzebnymi specjalnościami pod jednym dachem. Od mechaniki, poprzez techniki mikroprzepływowe, po mikrobiologię, bioinformatykę i software. To skoncentrowana wiedza zaowocowała stworzeniem naprawdę interesujących produktów. Produktów, które z jednej strony są bardzo zaawansowane, a z drugiej proste, dzięki temu mają bardzo duże szanse na wprowadzenie ich na rynek. Scope Fluidics świetnie zidentyfikował rynek i potrzebę rynku. Ten zespół wykonał kawał świetnej roboty i to jest autentycznie imponujące”.
-prof. Yoon Kyoung Cho- twórca program diagnostyki firmy Samsung
„Jako jeden z pionierów w tej dziedzinie uważam, że PCRone i Bacteromic są niezwykle użyteczne i synergicznie oferują niezwykłą wartość w diagnozowaniu i leczeniu chorób zakaźnych, przez co mogą potencjalnie zrewolucjonizować opiekę zdrowotną. Szybkość, wygoda obu systemów są naprawdę niesamowite. Różnorodność i praca zespołowa, którą można dostrzec w laboratorium to duży atut Scope Fluidics. W ten sposób spełniają się nasze marzenia. Niesamowite.”
Podsumowanie – uznane światowej sławy autorytety, naukowcy a zarazem praktycy wierzą w systemy diagnostyczne rozwijane przez spółkę. Jeśli ich wypowiedzi nie są potwierdzeniem jakości systemów i wysokiego prawdopodobieństwa dobrej sprzedaży, to co w takim razie jest ?
10) Motywowanie pracowników oraz akcje w posiadaniu zarządu
W programie motywacyjnym kluczowym pracownikom przyznawane są akcje fantomowe. Jest na nie przeznaczone 5% zysku ze sprzedaży, do 500 akcji na każdy projekt. W tej chwili projekt PCRone ma przyznane ok. 280 akcji, bacteromic 87 akcji. Firma przyznaje akcje za „kamienie milowe” w rozwijanych projektach. Uważa, że akcje fantomowe to najlepszy pomysł, bo nie rozwadnia kapitału i płaci za wykonana pracę.
Stan akcji w posiadaniu Zarządu : Piotr Garstecki 16,1 %, Marcin Izydorzak 15,8%, Szymon Ruta 2,0%
11) Jak są rozwijane są poszczególne projekty, na jakim są etapie – czyli kiedy możemy dojść do komercjalizacji ?
Oficjalny harmonogram spółki dotyczący rozwoju systemów diagnostycznych
PCRone
2) Badania przedrejestracyjne (planowana data: III kw. 2019 r. - I kw. 2020 r.)
W ramach tego etapu zrealizowane zostaną następujące pakiety działań:
2a) Przeprowadzenie serii testów prewalidacyjnych tj. ok. 100-200 próbek w celu wskazania aktualnego stanu rozwoju technologii systemu PCR|ONE;
2b) Uruchomienie linii produkcyjnej tj. samodzielne uruchomienie przez Spółkę produkcji chipów oraz analizatorów w zakresie niezbędnym do przeprowadzenia badań przedrejestracyjnych w warunkach umożliwiających odpowiednią kontrolę czystości, wymaganą dla poprawnego przeprowadzenia testów;
2c) Rozpoczęcie testów przedrejestracyjnych (weryfikacja i walidacja systemu) niezbędnych w procedurze rejestracji i certyfikacji systemu PCR|ONE - panel MRSA/SA.
3) Rejestracja i certyfikacja (planowana data: II kw. 2020 r.)
W ramach tego etapu zrealizowane zostaną następujące pakiety działań, kończące się:
3a) przeprowadzeniem audytu certyfikującego zgodnie z ISO 13485;
3b) wystawieniem przez Spółkę deklaracji zgodności stwierdzające zgodność systemu PCR|ONE z wymaganiami zasadniczymi właściwych dyrektyw Unii Europejskiej (oznakowanie CE);
3c) zgłoszeniem systemu PCR|ONE - panel MRSA/SA (jako wyrobu medycznego do diagnostyki in vitro) do Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych przed wprowadzeniem do obrotu.
4) Prezentacja systemu PCR|ONE na targach (planowana data: lipiec 2020 r.)
Zgodnie z raportem bieżącym nr 12/2018 Spółka współpracuje z międzynarodową firmą doradczą w zakresie pozyskania inwestora strategicznego zainteresowanego nabyciem systemu diagnostycznego PCR|ONE. Sprzedaż udziałów w spółce celowej Curiosity Diagnostics, w ramach której realizowany jest projekt PCR|ONE nie jest uwarunkowana wcześniejszą certyfikacją i rejestracją systemu. Praktyka rynkowa jednak wskazuje, że zwykle takie transakcje następują niedługo po tych zdarzeniach.
Bacteromic
1) Uzyskanie gotowości do industrializacji systemu oraz opracowanie projektu linii F&S (planowana data: IV kw. 2019 r.)
W ramach tego etapu zoptymalizowana zostanie konstrukcja chipa. Stworzone zostaną projekty zoptymalizowanych wersji modułu napełniającego oraz analizatora. Opracowany zostanie projekt wykonawczy linii F&S umożliwiającej nakraplanie wszystkich substancji wykorzystywanych w pierwszym planowanym panelu diagnostycznym. Ponadto przeprowadzone zostanie druga seria testów prewalidacyjnych systemu.
2) Uzyskanie gotowości do badań przedrejestracyjnych (planowana data: I kw. 2020)
W ramach tego etapu przeprowadzony zostanie pierwszy etap industrializacji analizatora. Wykonane zostaną 2-3 egzemplarze urządzenia oraz formy wtryskowe do wytwarzania chipów. Emitent otrzyma elementy chipów mikroprzepływowych wytworzonych metodą wtrysku. Uruchomiona zostanie pilotażowa linia napełniająca i sklejająca. Wytworzone zostaną chipy z odczynnikami w ilości niezbędnej do przeprowadzenia trzeciej serii testów prewalidacyjnych.
3) Badania przedrejestracyjne (planowana data: IV kw. 2020 r.)
W ramach tego etapu zrealizowane zostaną następujące pakiety działań:
3a) Przeprowadzenie serii testów prewalidacyjnych tj. ok. 400 próbek w celu wskazania aktualnego stanu rozwoju technologii systemu BacterOMIC - II kw. 2020 r.
3b) Uruchomienie linii produkcyjnej tj. samodzielne uruchomienie przez Spółkę produkcji chipów oraz analizatorów w zakresie niezbędnym do przeprowadzenia badań przedrejestracyjnych,- III kw. 2020 r.
3c) Rozpoczęcie właściwych testów przedrejestracyjnych (weryfikacja i walidacja systemu) niezbędnych w procedurze rejestracji i certyfikacji systemu Bacteromic- IV kw. 2020 r.
4) Rejestracja i certyfikacja (planowana data: II kw. 2021 r.)
W ramach tego etapu zrealizowane zostaną następujące pakiety działań, kończące się:
4a) przeprowadzeniem audytu certyfikującego zgodnie z ISO 13485;
4b) wystawieniem przez Spółkę deklaracji zgodności stwierdzające zgodność systemu Bacteromic z wymaganiami zasadniczymi właściwych dyrektyw Unii Europejskiej (oznakowanie CE)
4c) zgłoszeniem systemu BacterOMIC (jako wyrobu medycznego do diagnostyki in vitro) do Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych przed wprowadzeniem do obrotu
5) Prezentacja systemu BacterOMIC na targach (planowana data: lipiec 2021 r.)
Elementy sprawdzające postęp prac spółki
dla mnie osobiście w każdej spółce tego typu niezwykle ważnym elementem sprawdzającym jest przestrzeganie przyjętego harmonogramu. Jeśli są odstępstwa w każdy przypadku spółka musi bardzo dokładnie wytłumaczyć jaka była tego przyczyna i co zamierzają z tym zrobić. W przypadku Scope Fluidics (pomimo innowacyjności i naukowo-badawczego aspektu rozwijanych systemów, gdzie przesunięcia wydają się czymś naturalnym) przyjęty harmonogram był zawsze do tej pory realizowany perfekcyjnie co świadczy niezwykle pozytywnie o spółce.
12. Transakcje przejęć systemów diagnostycznych czyli za ile może to zostać sprzedane ?
Mediana wartości transakcji M&A wynosiła w 2018r 130 ml usd. Jednak bezpośrednim porównaniem dla systemu PCROne są transakcje podobnych aparatów diagnostycznych odnotowane od września 2013r do kwietnia 2019r. Wartości zawierają się w zakresach od od 450 do 120 mln usd (odrzucam jedną wartość skrajną 4 mld usd)
Ostateczna wartość przejęcia PCRONE będzie zależała od bardzo wielu czynników –od tych po stronie spółki m.in. parametrów zarejestrowanego i certyfikowanego samego urządzenia, oferowanych kartridży itp. oraz po stronie potencjalnego nabywcy – m.in. umiejscowienie potencjalnego zakupu w porfolio urządzeń nabywcy i jego polityce sprzedażowej. Te czynniki a raczej ich wypadkowa będzie wyznaczała cenę transakcyjną co na jest dzisiaj jest wartością nie do przewidzenia.
Bardzo ważnym aspektem dla inwestora jest fakt, iż co najmniej 50% środków uzyskanych z komercjalizacji systemów wypłacone zostanie w formie dywidendy.
Spółka dzięki m.in. obecności na targach AACC w Stanach Zjednoczonych nawiązała pierwsze relacje z potencjalnymi nabywcami PCR|ONE. Niektórych zaprosiła też do swojej siedziby.
Trzeba też pamiętać, że zazwyczaj transakcje tego typu odbywają się w momencie rejestracji (dopuszczenia do rynku), lub niedługo po tym zdarzeniu. Przygotowanie transakcji przebiega przed momentem rejestracji. Transakcje często dzielone są na upfront payment oraz milestone związany z realizacją jakiegoś dodatkowego celu technicznego - np. opracowania nowego panelu. Z tym, że (w odróżnieniu od projektów lekowych) zazwyczaj upfront payment obejmuje znaczną kwotę całej umowy a milestony mają tutaj stosunkowo niski procent udziału.
Analiza transakcji na przestrzeni ostatnich 6 lat wskazuje, że wraz z nasyceniem rynku tego rodzaju aparatami diagnostycznymi wartości transakcyjne maleją, chociaż jak twierdzą przedstawiciel spółki przybywa coraz więcej firm chcących mieć takie urządzenia w swoim portfolio.
Wiemy, iż PCRone jest bardzo konkurencyjny do innych tego typu urządzeń oferując rekordowo krótki czas badania (15-20 min), mnogość genów wykrywanych w pojedynczym badaniu oraz dodatkowy, niezwykle ważny element - łatwość modyfikacji panelu genów w przyszłości, w odpowiedzi na zmieniające się wyzwania epidemiologiczne. Wiemy też, iż spółka po planowej emisji akcji zamierza przeprowadzić szereg działań mających na celu maksymalizację wartości dokładnie opisanych w kolejnym punkcie. Jednak na rynku trwa swoisty wyścig i nowe urządzenia mogą za rok lub dwa zacząć poszukiwać swojego nabywcę. Dlatego też najważniejszym zadaniem spółki jest w aspekcie sprzedażowym optymalnie wyważenie elementów jak najszybszego czasu sprzedaży urządzenia w odniesieniu do czasu przygotowania jak najmocniejszych atutów maksymalizacji wartości projektu.
13. Finansowanie
Ostatnio spółka niespodziewanie zaskoczyła rynek informacją o emisji akcji na 16,2 mln zł. Zostaną wyemitowane akcje serii F na rzecz Total Fiz (największego akcjonariusza w spółce) w ilości nie większej niż 231540 akcji, przy czym Total Fiz sprzeda do rynku 170772 akcji za cenę nie wyższą niż 70 zł. Cena sprzedaży i nabycia akcji przez Total Fiz będą równe. Wg. przedstawicieli spółki to najprostsza, najtańsza i najszybsza forma emisji, jaką w tych warunkach można było przeprowadzić.
Wg. deklaracji spółki pieniądze będą potrzebne na :
1) PCRone – wzmocnienie pozycji negocjacyjnej, maksymalizacja wartości systemu, intensyfikacja działań w zakresie skutecznego dotarcia do jak najszerszego grona potencjalnych nabywców systemu- na ten cel zostanie przeznaczone 10 mln zł
Uzasadnienie spółki ”Od targów AACC, jesteśmy w intensywnej komunikacji z potencjalnymi odbiorcami systemu, prezentujemy się na targach, konferencjach i wsłuchujemy się w szczegółowe aspekty zainteresowania systemem. Dzięki temu widzimy teraz możliwość dalszego wzmocnienia pozycji negocjacyjnej - chcemy nie tylko mieć zarejestrowany system o wygrywającej funkcjonalności, ale również skrócić czas do poszerzenia potencjału rynkowego systemu PCR|ONE - przez poszerzenie portfolio paneli oraz skrócenie czasu do rejestracji w USA. Te plany skrystalizowały się w wyniku informacji pozyskane w ostatnim czasie, wierzymy w zasadność tego planu, cieszymy się też ze wsparcia głównego akcjonariusza”
Planowane działania
a) Przeprowadzenie procedury FDA Pre-Submission Program – czyli pierwszy krok wejścia na największy rynek na świecie (USA) : w tym wybór doświadczonego konsultanta, określenie zakresu i procedury rejestracji, przygotowanie i złożenie wniosku o pre-submission, interakcja z FDA, opracowanie programu badań klinicznych w USA zaopiniowanego przez FDA, rozpoznanie możliwości rozpoznania grantu w USA na sfinansowanie procedury rejestracji prze FDA
b) Plan przygotowania produkcji zgodnie z dobrą praktyką wytwarzania (GMP)- czyli zmniejszenie ryzyka transferu produktu, obniżenie kosztów produkcji chipa
c) Opracowanie nowych paneli – czyli zwiększenie potencjału komercyjnego PCRone : panel Flu/ab (grypowy) i gram-negative. To panele są najbardziej pożądane przez potencjalnych nabywców. Spółka deklaruje możliwość opracowania działających paneli do etapu sprawdzania wewnętrznego
d) Przeprowadzenie klinicznych studiów publikacyjnych w najważniejszych ośrodkach tego typu w Europie zakończone raportem wykorzystania systemu PCRone w warunkach klinicznych przez renomowane ośrodki.
e) Rozbudowa portfolia patentowego- wzmocnienie ochrony unikalnych technologii
f) Przeprowadzenie testów w formule Early Acess Program (EAP) poprzez udostępnienie systemu wybranym ośrodkom klinicznym. Najprościej mówiąc chodzi o feedback od użytkowników zakończone raportem z użytkowania sytemu.
2) Bacteromic – wkład własny do grantu Horyzont 2020 –przeznaczone zostanie 5 mln zł
3) Trzeci projekt- realizacja fazy proof of concept – przeznaczone zostanie 1,2 mln zł
Co ja o tym myślę
Ad1) Negocjacje pod wpływem czasu i braku pieniądze są głupotą, więc te pieniądze są spółce potrzebne (pozycja gotówkowa spółki kurczy się i jakiekolwiek przesuniecie terminu w negocjacjach miałby przykre konsekwencje dla spółki). Przeprowadzenie wstępnej procedury w FDA, opracowanie nowych paneli i inne działania mają wpływ na przyszłą wartość projektów, to dla mnie też jasne.
Jako osoba która często pracuje z szeroko pojętymi tematami innowacyjnymi, wiem doskonale, że nie wszystko można od początku przewidzieć, że to pierwsze poważne negocjacje spółki i dopiero rozmowy z potencjalnymi nabywcami dały know-how jakie dalsze kroki podjąć aby PCRone jak najdrożej sprzedać. Te planowane działania to właśnie efekt tych informacji zwrotnych od potencjalnych nabywców, których interesowały : nowe panele m.n. grypowe, jak wygląda procedura ceryfikacji systemu w FDA, feedback od użytkowników systemu, dane ze studiów klinicznych z renomowanych ośrodków .
Zgodnie z deklaracją spółki PCRone będzie certyfikowany i zarejestrowany do 30.06.2020r ale w moim przekonaniu ew. komercjalizacja może (ale oczywiście wcale nie musi) się przesunąć np: kilka m-c jeśli okazałby się, ze w wyniku dodatkowych negocjacji (lub np: zakończenia określonego działania, planowanego z obecnej emisji) można uzyskać wyższą ceną sprzedaży, co jest w oczywistym interesie akcjonariuszy.
Jeśli miałbym mieć zastrzeżenia, iż coś wcześniej można było przewidzieć to przede wszystkim do Clairfielda, który mając odpowiednie doświadczenie powinien wiedzieć, że do tego typu negocjacji sprzedażowych nie należy przystępować z kończącymi się w portfelu pieniędzmi. Ponadto, wydaje się, iż można był wykonać wstępny research czego oczekując nabywcy podobnych systemów jak PCRone. Ogłoszenie np.: pół roku temu w harmonogramie emisji akcji uzależnionej od np.: pozytywnego zakończenia testów prewalidacyjnych Alabu (spółka pokazuje postęp prac i wtedy dopiero prosi inwestorów o pieniądze) dałoby chyba bardziej przejrzystą procedurę przy braku zaskoczeń rynkowych. Ale ponieważ jestem generalnie przeciwnikiem stwierdzeń „trzeba było…” a ponadto nie mogę mieć dostępu do wszelkich przesłanek dlaczego zastosowano takie postępowanie a nie inne ten temat pozostawiam, jednoznacznie podkreślając, iż rozumiem na co spółka chce wydać pozyskane pieniądze, jest to dla mnie zrozumiałe i logiczne.
Ad2) tutaj temat jest zupełnie jasny - Zgodnie z raportem nr 15/2019 Bacteromic sp. z o.o. pozyskał już pozytywną rekomendację do dofinansowania w ramach europejskiego programu Horyzont 2020 w kwocie 1,93 mln EUR na rozwój systemu BacterOMIC. Potrzeby kapitałowe związane z pozyskaniem wkładu własnego do grantu oraz pokryciem niezbędnych kosztów, których nie będzie można uznać za kwalifikowane zgodnie z umową, określone zostały na 5 mln PLN.
Ad3) jeszcze niedawno spółka deklarowała brak możliwości realizacji tego tematu rzucając wszystkie siły na dokończenie systemów diagnostycznych i sprzedaż jednego z nich czyli PCRone. Jednak wynikało to pewnie nie tylko z braków kadrowych a zwyczajnie z braku pieniędzy na ten cel. Przyjmuje tłumaczenie, ze pewne prace koncepcyjne zwyczajnie trwają i nie da się tego przyspieszyć i jeśli mogą przy okazji obecnej emisji pozyskać 1,2 mln (tj. 100 tys. miesięcznie) na nowy projekt to należy to zrobić mając na celu przeszły rozwój spółki.
14. Ryzyka
Czy są? – oczywiście, że tak, to startup i programy badawcze dlatego ryzyka oczywiście istnieją. Najważniejsze ryzyka to moim zdaniem : przeciąganie się certyfikacji PCRone, brak finansowania lub odejście kluczowych osób.
Bardzo mi się mi się podoba określenie ryzyk (dotyczących PCRone) wg. prof. Garsteckiego : „Jeśli się spytać kogoś, kto robi prototypy, to powie że ryzyka nie ma żadnego, bo to już działa. Jak się spytać industrializatora, który będzie to produkował, to on widzi wiele szczegółów, które musi jeszcze zoptymalizować i pewnie może przypisać temu jakieś ryzyka. Ale moim zdaniem byłoby to ryzyko raczej wyrażone w czasie lub koszcie końcowym. Uważam, że pytanie „czy to się uda” jest już nieaktualne. Z kolei gdyby się spytać kogoś, kto będzie to sprzedawał, mając już gotowy produkt dopuszczony do rynku, powie że dopiero teraz otwiera się worek z ryzykiem”
Z dodatkowych ryzyk trzeba pamiętać, że spółka jest na NewConnect co oznacza stosunkowo niska płynność, możliwe bardzo duże wahania zmiany wartości akcji w szczególności przy określonych komunikatach – zarówno pozytywnych jak i negatywnych.
Ryzyka terminowego realizowania harmonogramu - ja podchodzę do tego tak : dopóki raz zarząd nie zawiedzie mojego zaufania i będzie realizował perfekcyjnie harmonogram jak robił do tej pory, mam prawo zakładać (przynajmniej założyć duże prawdopodobieństwo), że tak dalej będzie. Do tej pory harmonogram działań był przez spółkę przestrzegany perfekcyjnie.
15) Podsumowanie
Tradycyjnie w moich analizach nie ma podsumowania. Dokonałem olbrzymią cześć pracy za inwestora zbierając i porządkują fakty, teraz każdy wnioski niech sobie wyciągnie sam i podejmie swoją decyzję inwestycyjną.
Dodatek do analizy, jak patrzę na inwestycję w spółkę innowacyjną
Rozmawiając z wieloma inwestorami nt. spółek innowacyjnych czyli startupów mam wrażenie , ze dominują dwa podejścia :
podejście nr 1- powszechniejsze, mówiące, że startup ma 5 lub mniej procent na przeżycie, wiec trochę „mogę włożyć to może się uda".
Podejście nr 2 - o wiele rzadsze opiera się na analizie - im głębszej tym lepiej : ludzi tworzących startup, biznesu który chce rozwijać, rynku i tysiąca innych elementów na końcu których można sobie odpowiedzieć ile procent prawdopodobieństwa można przyłożyć do sukcesu tej konkretnej firmy.
Do pierwotniej analizy podejścia nr 2 dochodzi następnie mozolne śledzenie dokonań spółki, przestrzegania ustalonego harmonogramu, przechodzenia przez kolejne elementy które albo wzmacniają ustalone początkowe prawdopodobieństwo albo osłabiają. Dodam tylko, że moim zdaniem taka analiza jest o wiele trudniejsza w przypadku startupu niż w przypadku rozwiniętej firmy. To dziesiątki, a częściej setki lub nawet tysiące godzin pracy takiego inwestora.
Czy na końcu tej drogi będzie czekała nagroda? to możliwe a na pewno o wiele bardziej prawdopodobne niż w przypadku podejścia nr 1.
Czy jest to dla każdego?- nie, nie każdy ma czas, chęć, a niektórzy chcą poczuć po prostu adrenalinę rynku, a nie dokonywać analiz.
Czy jedno podejście jest lepsze od drugiego? Każdy musi sobie na to pytanie sam odpowiedzieć
Parę zdań dotyczących ogólnych założenia co do mojej pojedynczej posiadanej pozycji. Otóż jaka ona ma udział w portfelu (udział startowy) jest uzależnione od dość skomplikowanego algorytmu obejmującego : potencjał wzrostu ceny, czas realizacji potencjalnie pozytywnego scenariusza, prawdopodobieństwo wystąpienia takiego scenariusza (to jest bardzo szerokie zagadnienie budowane na elementach fundamentalnych), zagrożeń, zmienności na kursie, płynności i potencjału wzrostu ceny. A najprościej mówiąc - po dogłębnej wstępnej analizie (informacje fundamentalne, rozmowy z zarządem, obejrzenie spółki itp) ustalam pewien początkowy udział w portfelu w zależności od zmiennych jak wyżej i obserwuję dokonania spółki. W razie jak zmienne oscylują np: wzrasta prawdopodobieństwo dobrego scenariusza jestem w stanie dodatkowo dokupować akcje lub zmniejszać udział jeśli okaże się, że wstępna moja analiza była nie taka jak powinna. Jednak ten udział spółki w portfelu musi wytrzymać np: 50% procentowy spadek kursu (w startupach, przy niskiej płynności to nic dziwnego), jeśli nawet tak się stanie to niespecjalnie mnie to powinno dotknąć mentalnie.
Chodzi o to, że dla mnie cena akcji spółki dzisiaj notowana na 60 zł może równie dobrze wynosić 30 czy 100 zł – to całkowicie bez znaczenia ponieważ wnosi do inwestowania tylko element emocjonalny a nie merytoryczny. Najważniejszy jest efekt końcowy czy spółka dojdzie do określonego celu (a z tym przyjdzie ostateczny zysk z inwestycji) a temu służy analiza i działania opisane jak wyżej.
|
|
Temat:
SCPFL
Wczoraj byłem w Warszawie na konferencji i moje spojrzenie na temat
Niewątpliwie powinno zostać dogłębnie wytłumaczone po co PCRone potrzebuje tych 10mln zł. Nikt nie kwestionuje dofinansowania do bacteromica ani tworzenia trzeciego projektu, to właśnie pieniądze na zwiększenie przewagi PCRone budzą największe emocje. Moim skromnym zdaniem, trzeba było przyjąć i szczerze powiedzieć, że nie wszystko można od początku przewidzieć, że to ich pierwsze poważne negocjacje i dopiero rozmowy z potencjalnymi nabywcami dały know-how jakie dalsze kroki podjąć aby PCRone jak najdrożej sprzedać. Te planowane działania to właśnie efekt tych przemyśleń. Zgodnie z deklaracją PCRone będzie certyfikowany i zarejestrowany do 30.06.2020r ale, w moim przekonaniu, ew. komercjalizacja może (ale oczywiście wcale nie musi) się przesunąć np: kilka m-c jeśli kazałby się, ze w wyniku dodatkowych negocjacji (lub np: zakończenia określonego działania, planowanego z obecnej emisji) można uzyskać wyższą ceną sprzedaży, co jest w oczywistym interesie akcjonariuszy.
Przyznam, ze o samej emisji czytałem już w pociągu w drodze do Warszawy i moja uwaga była skoncentrowana na samych produktach i ich rozwoju a nie na samej emisji -bo to stanowi dla mnie o wartości spółki. Gdyby ta informacja poszła dzień wcześniej, zebrałbym pytania z forum i zadawałbym na ten temat również.
Tło i podsumowanie - wczorajsza informacja o emisji trafiła na rynek bardzo niespodziewanie i nieprzyjemnie, trzeba pamiętać, że spółka jest startupem a większość uczestników rynku posługuje się statystykami i wcześniejszymi brzydkimi historiami z dodatkowymi emisjami i nieuczciwymi zarządami w roli głównej. Mało kto analizuje to, kim są ludzie w spółce, jakie są ich CV i dotychczasowe osiągnięcia. Niestety jak zawsze liczą się powierzchowne i szybkie spojrzenie, a to niestety nie wypadły tu najlepiej.
Najważniejsze- sporo pytań zadawałem po spotkaniu, dotyczyły one projektów.
Moje zdanie na dzisiaj- główny temat (PCRone i Bacteromic) jest czysty i zostanie sprzedany za dobre pieniądze , stracić na tym nie można (przynajmniej prawdopodobieństwo jest bardzo małe). Negocjacje pod wpływem czasu i braku pieniądze są głupotą, więc te pieniądze są spółce potrzebne. Przeprowadzenie wstępnej procedury w FDA, opracowanie nowych paneli i inne działania mają wpływ na przyszłą wartość projektów, to dla mnie też jasne. Ale spółka w trybie pilnym musi szeroko wyjaśnić szczegółowo te działania i rozwiać wątpliwości inwestorów w związku z planowana emisja, w swoim dobrze pojętym interesie.
|
|
Temat:
SCPFL
Składam fakty : - przyśpieszenie terminu publikacji raportu kwartalnego o z 14.11 na 13.11- 13.11. godz. 12.00 video konferencja „podczas której zostaną omówione realizowane projekty innowacyjne oraz aktualizacja planu ich rozwoju”www.facebook.com/events/697658... Link do wideo konferencji: https://bit.ly/2CoCsP5- 14.11. godz. 14.00 chat ze spółką na strefie inwestorów strefainwestorow.pl/artykuly/c...Nie będę dywagował , ale dość niezwykły zbieg wydarzeń jak na zwykły raport kwartalny i po raz pierwszy w historii spółki video konferencja.
|
|
Temat:
SCPFL
Są po badaniach przedcertyfikacyjnych wyszły bardzo dobrze, w pełni porównywalne z bezpośrednim konkurentem GeneXpertem. infostrefa.com/infostrefa/pl/w...Jednocześnie przypominam PCRone/GeneXpert – 5x więcej genów, 3x szybciej. Szybkość to element oczywisty ale i mnogość genów wykrywanych w pojedynczym badaniu oraz łatwość modyfikacji panelu genów w przyszłości to również bardzo ważny element dla BigFarmy na zmieniające się wyzwania epidemiologiczne. + Cena badania- jaka oczywiście nie wiemy ale na wielu spotkaniach wspominali, że cena GE to 50 euro za MSRA, 100 EUR za clostrydium/1 badanie, a oni dążą do granicy dwudziestu kilku euro. Atutów mnóstwo, produkt szybszy, tańszy, więcej genów (możliwość modyfikacja w przyszłości) to teraz jest to dla mnie kwestia czasu i tyle.
|
|
Temat:
PURE
Nie jestem pewien co do końca masz na myśli, ale przekażę Tobie co wiem o poprzedniej i przyszłej emisji. Zmieniają strukturę akcjonariatu aby wprowadzić spółkę na GPW , dlatego emisja objęła 75% fundusze (czy coś wokoło tego). Chodzili wokół tych funduszy dość mocno i udało się to zrobić. Zapisy na akcje były otwarte , otrzymał ten kto chciał, cena była ustalona jako średnia (zdaje się z 2 poprzedzających m-cy) i tyle. Zadbali jak mogli aby jak najwięcej stabilnego akcjonariatu wchodziło i to się udało, a kto objął pozostałą cześć (długoterminowy inwestor czy spekulant) na to nie mają za bardzo wpływu. Jak napisałem w analizie z kontekstu wynikało, iż będzie jakaś mniejsza emisja pomostowa raczej początek 2020 a po pokazaniu programów do komercjalizacji kolejna większa emisja na przełomie w 2020/2021r. Nie chcę się powtarzać, w analizie są też inne informacje nt.temat ale to wszystko na tę chwilę, co wiem.
|
|
Temat:
PURE
Sprawozdanie z dnia otwartego Pure Biologics w dniu 22.10.2019 oraz moje całościowe spojrzenie na spółkę.Dawno nikt nie pokusił się o całościowe spojrzenie na spółkę, dlatego wykorzystam ostatnie spotkanie aby połączyć to co spółka przedstawiła z tym co już o niej wiemy i stworzyć jednolity i spójny tekst. Taki opis spółki dokonał na portalu stockwatch Analityk Fundamentalny ale po pierwsze było to w sierpniu po wynikach z II kw, a po drugie patrzymy na spółki (szczególnie na startupy) z Analitykiem Fundamentalnym w nieco w inny sposób i dlatego niniejsze opracowanie będzie zupełnie inne. Zaznaczam, nie przedstawiam wszystkiego od początku, ale same najważniejsze elementy części biznesu spółki dla tych, którzy ją obserwują i się nią interesują. W którym miejscu są, co już zdołali zrobić, do czego dążą i jakie po drodze są ryzyka inwestycyjne. Zastrzegam, iż nie będę dotykał opisu części usługowej ponieważ jej wartość, przy wartości części B+R jest dla mnie bez znaczenia. Zaznaczam też, nie mam przygotowania z biotechnologii, z góry wiec przepraszam za ew. przeinaczenia elementów naukowych, jeżeli takie nastąpią lecz idea jest inna- to tekst napisany przez inwestora dla inwestorów w celu lepszego zrozumienia specyfiki spółki, pracującej w bardzo trudnej dla laika branży jaką jest biotechnologia a co za tym idzie dokonania własnego podsumowania analitycznego. W jakiej przestrzeni spółka pracuje czyli o co chodzi w tym biznesiePure Biologics jest jedną z niewielu spółek w Polsce na poważnie realizującej programy badawcze w zakresie immunoonkologii. Ta dziedzina to przyszłość i w coraz większym stopniu teraźniejszość dzisiejszej onkologii, o tym mówią wszystkie autorytety medyczne i ta kwestia jest bezdyskusyjna. Na spotkaniu Spółka pokazał przestrzeń, w której pracuje, w tym dane podstawowe :85 specjalistów w tym 45% w stopniu doktora, 1000 m2 laboratoriów, 2 własne platformy technologiczne do generowania cząstek do programów badawczych PureSelect2 (platforma do generowania białek i przeciwciał) oraz PureApta (platforma do generowania tzw. aptamerów czyli sztucznie wygenerowanych łańcuchów DNA lub RNA przypominających przeciwciała). Własne platformy Jak podają przedstawiciele spółki , takich platform jest najwyżej kilkanaście na świecie. Ale z praktycznego punktu widzenia inwestora, pomijając możliwość wykonywania dość unikalnych zleceń kontraktowych na własnych platformach, wynika jedna o wiele ważniejsza sprawa – spółka realizując programy badawcze zaczyna zawsze od generowania przeciwciał czy też aptamerów wykorzystując własną platformę. Jest to o wiele tańsze, prostsze i wielokrotnie lepsze rozwiązania od tych laboratoriów, których takich platform nie mają. Po pierwsze inne laboratoria muszą taką cząstkę zamówić – co zajmuje czas i kosztuje, po drugie jeśli okaże w trakcie badań, że zamówione cząstki nie posiadają pożądanych właściwości trzeba się z powrotem cofnąć i zamówić kolejne cząsteczki badawcze. To wszystko trwa i kosztuje, w Pure Biologics nie ma tego rodzaju problemu bo platformy są ich własnością i to jest wielka wartość dodana spółki. PureApta posiada patent w USA, w Europie jest w trakcie procesu rejestracyjnego, PureSelect2 jest w trakcie rozwoju , ale na bieżąco generuje cząstki na potrzeby spółki. Otoczenie oraz obszary pracy spółki Spółka pracuje w obszarze onkologii a raczej immunoonkologii w zakresie odkrywania leków biologicznych i programów aptamerowych a więc tam gdzie ceny transakcyjne są znacznie wyższe niż tradycyjnych leków chemicznych a światowa BigFarma chcąc nie chcą podąża w tym kierunku. Dlaczego imunoonkologia jest tak atrakcyjna dla Bigfarmy ? – otóż ze względu na większe bezpieczeństwo dla pacjenta (minimalizowanie skutków ubocznych w odniesieniu do leków konwencjonalnych), wykorzystanie naturalnych środków obronnych organizmu, o wiele szerszy zakres wskazań - leki tradycyjne potrafią mieć wyłącznie jedno wskazanie (czyli prościej chorobę, którą leczą) /lub max kilka, w imunoonkologii kilka/kilkanaście wskazań nie jest niczym dziwnym. Spółka może sprzedać licencję na cząsteczkę/ lub na określone wskazania a dalej powiększając pakiet wskazań dodatkowo monetyzować swoją pracę. Dlatego też obszar ten charakteryzuje się o wiele szybszą komercjalizacją (w lekach konwencjonalnych proces ten następuje zazwyczaj w czasie drugiego lub trzeciego etapu klinicznego) tutaj 50% cząstek w czasie badań posiada partnering w fazie przedklinicznej i aż 80% w czasie I fazy klinicznej. Wynika z tego, iż komercjalizacja w obszarze, w którym porusza się spółka następuje wiele lat wcześniej niż w lekach konwencjonalnych, co oczywiście jest o wiele atrakcyjniejsze zarówno do spółki jak i dla inwestorów. Realizowane projekty Spółka w chwili obecnej posiada 3 projekty lekowe oparte na przeciwciałach : PB001 Multibody (rak jelita grubego i odbytu), PB003 PureActivator (niedrobnokomórkowy rak płuc), PB004 PureBike (potrójnie negatywny rak piersi) oraz 3 projekty terapeutyczne oparte na aptamerach : PB002 AptaPheresis, PB005 Apta-MG, PB006 Apta-MLN. Spółka celuje w obszar leków first in class, czyli krótko mówiąc leki w obszarze innowacyjnym, realizując/odkrywając nowatorskie podejście do mechanizmu działania cząstki leczniczej, który w określony sposób ma zadziałać (na tzw. cel molekularny) i zahamować daną chorobę. To tzw. MOA – mechanism of action, czyli mechanizm działania cząsteczki leczniczej na poziomie molekularnym, np. wiązanie określonego receptora białkowego. Dla inwestora jest ważne, że to najbardziej atrakcyjny kawałek tortu poszukiwania nowych leków, z najwyższymi cenami transakcyjnymi ponieważ wiele spółek pracuje w obszarze, gdzie MOA już jest określony i wytwarzają tylko kolejne przeciwciała o tej samej zasadzie działania. W tym drugim obszarze, jak mówią przestawicie spółki jest już gęsto (duża konkurencja i sporo kandydatów na leki), a jeśli jest gęsto to i ceny transakcyjne są rzecz jasna o wiele niższe. Jak są rozwijane są poszczególne cząsteczki, na jakim są etapie – czyli kiedy możemy dojść do komercjalizacji ?Multibody PB001 O co chodzi w tym leku ? celem jest tutaj zdjęcie hamulców blokujących limfocyty czyli komórki odgrywające bardzo ważną rolę w systemie odpornościowym człowieka, które zostały zablokowane przez nowotwór. Cząstki aktywne stworzone przez spółkę mają zawsze dwa cele – w tym przypadku zdjęcie hamulców blokujących limfocyty (czyli MOA) , drugim celem dla każdej odkrywanej cząstki jest zawsze bezpieczeństwo. W tym projekcie badawczym jak twierdzą przedstawicie spółki, w laboratorium cele nr 1 i 2 są potwierdzone, nie tylko na komórkach ludzkich ale tez mysich i małpich – to ważne bo badania przedkliniczne na zwierzęta są wtedy o wiele tańsze i prostsze i nie trzeba specjalnie modyfikowanych myszy z komórkami ludzkimi. Spółka przygotuje się do rozpoczęcie w drugiej połowie przyszłego roku badań przedklinicznych, czyli tego etapu gdzie można by rozpocząć komercjalizować projekt.[ Mniej zaawansowany jest projekt PB003 PureActivator ( etap uzyskania kandydatów) , a jeszcze mniej PB004 PureBike (wybór celu). Po tabelę z pipeline odsyłam na str. 22 prezentacji. Nie będę tutaj opisywał dokładnego mechanizmu działania tych dwóch cząstek, ponieważ z inwestorskiego punktu widzenia, niewiele to wnosi, dość wiedzieć, że za najbardziej zaawansowanym PB001 Multibody są też rozwijane inne cząstki aktywne. Spółka podaje też informację, ze każda z tych rozwijanych cząstek realizując oczywiście first in class reprezentuje zupełnie inne podejście naukowe co jest wartością dodaną dla potencjalnych zainteresowanych firm farmaceutycznych. Na rynku zdarzają się takie transakcje by BigFarma kupowała daną cząsteczkę jednocześnie „rezerwując” prawo pierwokupu kilku innych, które były w badaniach właśnie poprzez unikalność i różnorodność podejść badawczych. Niestety, nie czuję się kompetentny do oceny tego elementu, a nie był on zbyt mocno rozwijany na spotkaniu, więc informację tę podaję tylko dla porządku. Aptamery – jak podano powyżej pipeline spółki, w tym zakresie, stanowią : PB002 AptaPheresis (wskazanie zespół Devica) , PB005 Apta-MG (wskazanie miastenia rzekomoporaźna), PB006 Apta-MNL (wskazanie czerniak). W dwóch pierwszych projektach spółka wykorzystuje aptamery w urządzeniach medycznych. Są to działania celowe, ponieważ, jak mówią specjaliści, choć aptamery to przyszłość (są m.in. o wiele bardziej stabilne niż białka i ich produkcja jest przez to prostsza i bardziej powtarzalna) to lek oparty na aptamerach na świecie jest zaledwie jeden, kilkanaście jest w badaniach klinicznych. Spółka pragnąc powiększać swoją kompetencje w tym zakresie realizuje na razie urządzenia medyczne oparte na aptamerach, a jednocześnie obserwując rynek rozwijany w tym obszarze. Podobnie jak w zakresie cząstek białkowych Multibody, tutaj najbardziej zaawansowany projekt to ApthaPheresis PB002. O co chodzi w ty projekcie ?– u chorych na tę rzadką chorobę-zespół Devica- obecnie stosuje się tzw. plazmaferezę tzn. przetacza się krew chorego usuwając szkodliwe (uszkodzone) białka. Niestety metoda ta ma mnóstwo skutków ubocznych bo razem z uszkodzonym białkiem oczyszcza osocze z wszystkiego co człowiek potrzebuje do życia. A aptamer Pure Biologics w specjalnym urządzeniu usuwa wyłącznie białko odpowiedzialne za chorobę bez czegokolwiek innego. Spółka jest na dobrej drodze aby pokazać projekt na koniec roku 2019/początek przyszłego 2020. Są dość pewni swego, jak mówią oczywiście w laboratorium zawsze może coś nie wyjść, to co pokażą będzie równoznaczne z prototypem. Wg. spółki jednoznacznie model działa. A wiec w przyszłym roku projekt może wchodzić w fazę pozwalającą na przygotowania do procesu przyszłej komercjalizacji.PB005 i PB006 – projekty są na o wiele wcześniejszym etapie. Umowy w obszarze immuonoonkologii realizowane z Big Farmą na świecieSpółka pokazała statystyki liczby umów w zakresie immunoonkologii (partering +M&A) – ten rynek rośnie z roku /rok, od 300 umów w 2012r po ok. 700 umów w 2018r Płatności Upfront – wielkości również rosną z roku/rok jednak jest to obraz zakłócony przez kilka większych transakcji, bardziej prawdziwym jest stwierdzeniem, iż mediana umów miała takie płatności w zakresie 30-40 mln USD. Kiedy BigFarma wchodzi w projekty ? jak wspomniano już powyżej - 50% projektów posiada partering w fazach przedklinicznej, 80% w I klinicznej. A wiec jest to bardzo dużo i stanowi zupełnie inne reguły gry niż w przypadku leków tradycyjnych.Transakcje referencyjne Na spotkaniu spółka pokazała 4 wybrane transakcje referencyjne. Jak zapewnia spółka transakcje te zostały precyzyjnie dobrane pod względem podobieństwa i dotyczyły bardzo podobnych obszarow terapeutycznych ( Immunoonkologia) oraz cząstek aktywnych leku jak rozwijane przez nich ( przeciwciała bispecyficzne jako cząstki aktywne leku w kategorii First- in –class). Podane wartości to od 15 mln eur (transakcja na początku fazy przedklinicznej) do 120 mln USD ( transakcja po pierwszej fazie klinicznej) jako Up-front + 0,6 do 1,7 mld Milestones + Royalties /jedną cząsteczkę.Przyznaję, że wartości są prawie niewiarygodne w odniesieniu do obecnej kapitalizacji spółki. Można oczywiście, na tej podstawie, policzyć też wartość spółki posiłkując się prawdopodobieństwem dojścia do poszczególnych faz i wartością pieniądza w czasie. Ja tego robić nie będę. Należy przy tym przypomnieć, że wszystkie realizowane projekty są zaplanowane do zakończenia pierwszej fazy klinicznej i mają do tej fazy zapewnione dofinansowanie z NCBR. Spółka nie deklaruje jeszcze kiedy będzie komercjalizować– czy na bardzo wczesnym etapie fazy przedklinicznej czy poczekać za większą premią związaną oczywiście z rozwojem projektu. W moim przekonaniu pierwsza lub dwie transakcje powinny być dość szybko realizowane aby spółkę uwiarygodnić. Ale chyba pewnie nawet sama spółka takich decyzji nie podjęła, ponieważ zależy to od wielu zmiennych na dzisiaj nieznanych. Organizacja spółki6 wysokospecjalizowanych grup badawczych m.in. Zespoły Aptamerowy, Inżynierii Białka, Przeciwciał, Biologii Molekularnej itd. , Biuro zarządzania Projektami, Zespół naukowych menadżerów projektu Nowe działy to: HR –z doświadczeniem współpracy z naukowcami, Dział scoutingowy i doradczy, który obserwuje transakcje referencyjne + inne aktualności rynku oraz bardzo ważne nowe zespoły – z ludźmi, którzy przygotowują badania przedkliniczne z doświadczeniem międzynarodowym.Pieniądze na badania i przyszłe emisje Wszystkie projekty komercyjne będą realizowane do końca 2023r (jeden do połowy 2023). Katalog projektów na dzisiaj jest zamknięty. Koszty pozostałe do poniesienia to 134 mln w tym dotacje 99,3, wkład własny 34,8 mln, patrz- do pozyskania od inwestorów.Padały pytania o dotacje z NCBiR-u – przesunięcia w rozliczeniach płatności są i wynoszą 3,4 m-ce. To całkowicie normalne. Zapotrzebowanie na pieniądze wraz z rozwojem programu raczej są stabilne w czasie, ale występują tutaj piki i przesunięcia. Dział rozliczeń rozlicza wydatki co miesiąc. Przesunięcia płatności lub chwilowe opóźnienia z NCBiR-u to kwoty od kilkuset do czasami kilku mln, wynika to ze specyfiki rozliczeń np.: procedur potwierdzenia realizacji projektów lub kwot zaliczek do zamówień które są konieczne są przy niektórych zamówieniach. Jak wszyscy wiemy, ostatnia emisja była w kwietniu 2019r i miała w założeniu starczyć na rok, półtora ale kiedy przyszły kolejne projekty badawcze to wydatki wzrosły ok. x 1,5 (50% w stosunku do wartości projektów przy emisji). Nowe projekty były planowane do realizacji z dużym wyprzedzeniem, a na uzyskanie dofinansowania zakładano proceduralnie dłuższy okres , udało się je pozyskać w krótkim czasie już teraz . Zgodnie z wypowiedziami przedstawicieli spółki mogliby się wstrzymać do połowy roku 2020 i skoncentrować się tylko na uruchomionych już projektach, tym samym pokazać bardzo konkretnie co mają do komercjalizacji– projekty AptaPheresis i Multibody, ale to nie byłoby racjonalne i nie w interesie spółki i ich akcjonariuszy, żeby nie ruszyć do przodu z wszystkimi posiadanymi projektami. Dzięki temu nie będzie przestoju prac i wszystkie zespoły będą wydajnie pracować. Dlatego z kontekstu wynikało, iż będzie jakaś mniejsza emisja pomostowa raczej początek 2020 a po pokazaniu programów do komercjalizacji „z przytupem” kolejna większa emisja na przełomie w 2020/2021r. Wg. spółki to jedyny sposób aby działać fair tj. aby wchodzenie kolejnych inwestorów, lub zwiększenie zaangażowania obecnych odbywało się z mniejszym ryzykiem (kiedy spółka pokaże co zrobiła) ale i po wyższej cenie. Tak pracują inwestorzy instytucjonalni, którzy w czasie ostatniej emisji pozyskali duży udział nowych akcji. Prywatnie przyznaję, ze bardzo mi się to podoba, od strony strategii zarządzania portfelem a także od strony spółki, która prosi o wkład własny w momencie jak coś pokazuje. Program motywacyjny Spółka traktuje pracowników jako swój największy kapitał. I trudno się z tym nie zgodzić, bo to oni są decydującym ogniwem czy ma szansę na sukces czy też nie.W październiku nastąpiła deklaracja oddania własnych akcji przez Akcjonariuszy Założycieli celem realizacji Programu motywacyjnego. Jak sobie policzyłem dotyczy to aż 14,6% kapitalizacji spółki i ok. 26% akcji posiadanych przez Akcjonariuszy Założycieli. W tym celu uprzywilejowane akcje imienne serii A (posiadające dwa głosy na jedną akcję) zostały zamienione na akcje zwykłe na okaziciela Nie pamiętam zachowania jakiekolwiek spółki na giełdzie w ten sposób w takim zakresie.Żeby niepotrzebnie się nie rozwadniać, krótko : dla mnie taka postawa to objaw szacunku dla akcjonariuszy i potwierdzenie świadomości tego co stanowi największą wartość tego rodzaju spółki – ludzie i to najlepsi, trzeba ich przyciągać lub jeśli są zatrzymać i zmotywować. Wtedy spółka będzie miała prawdopodobieństwo uzyskania jak najlepszych wyników prac oraz uzyskania oczekiwanego wyniku, wycena eksploduje i wszyscy zarobią. To myślenie strategiczne i długofalowe niedostępne dla zarządów większości spółek giełdowych a tu urealnione i zrealizowane. Program motywacyjny będzie realizowany do końca 2021r, na akcje będą podpisane umowy lock-up. RyzykaCzy są? – oczywiście, że tak, to startup i biotechnologia oraz programy badawcze dlatego ryzyka oczywiście istnieją, najważniejsze ryzyka to : posypanie się badań, brak finansowania lub odejście kluczowych osób.Ale trzeba też pamiętać, że ryzyka te są zarządzane i ograniczane – spółka posiada 6 programów badawczych dofinansowanych w 75% przez NCBiR. Dwa programy wg. spółki w drugiej połowie przyszłego roku będą wchodziły w fazy pozwalające przygotowywać je do przyszłej komercjalizacji. Jest duży program motywacyjny. I trzeba pamiętać, że komercjalizacja w zakresie leków biologicznych jest realizowana na o wiele wcześniejszym stopniu niż w lekach konwencjonalnych a i ryzyka statystycznie są tutaj dużo niższe. Z dodatkowych ryzyk trzeba pamiętać, że spółka jest na NewConnect co oznacza bardzo niska płynność, możliwe bardzo duże wahania zmiany wartości akcji w szczególności przy określonych komunikatach – zarówno pozytywnych jak i negatywnych. Pamiętajmy jednak o sygnałach Spółki przygotowywania się do spełnienia standardów wymaganych na GPW PodsumowanieNie będzie podsumowania, każdy wnioski niech sobie wyciągnie sam i podejmie swoją decyzję inwestycyjną. Dodatkowe informacje- Dla uzupełniania opracowania przesyłam link na prezentację spółki, która jak wszyscy uczestnicy spotkania otrzymałem z Innervalue. Prezentacja jest zamieszczona na stronie spółki, wobec tego przekierowuje na link: purebiologics.pl/prezentacja-z...- Ponieważ wiele osób mnie o to pyta – tego rodzaju spotkania z różnymi spółkami (jak ostatnie z Pure Biologics) z zakresu biotechnologii, gamingu i inne organizuje Innervalue , trzeba zapisać się na newsletter a https://newsletter.innervalue.pl/. Polecam, sam często korzystam, spotkania z zarządami to najlepsze źródło informacji. A jak mnie dane spotkanie lub spółka nie interesuje to istnieje cudowny przycisk na klawiaturze, który usuwa tę informację w ułamku sekundy. - i kolejna sprawa o którą jestem pytany : jak uczestniczyć w emisjach akcji małych spółek ? Trzeba napisać do Domu Maklerskiego Navigator, oni specjalizują się i organizują mnóstwo emisji małych spółek. Ze względu na RODO należy podpisać umowę, która jest bezpłatna i do niczego nie zobowiązuje, ale pozwala im przesyłać informacje o ofertach akcji różnych spółek. Po podpisaniu umowy, zaczynamy od czasu do czasu otrzymywać tego rodzaju oferty. A jeżeli nas dana oferta nie interesuje to działanie na przycisku delete jak wyżej…
|
|
Temat:
PURE
Jakie lubię konkrety i merytoryczną analizę jak w moim poście poniżej.
|
|
Temat:
DATAWALK
Jak wskazał wyżej bankrucik kolejne wdrożenie, tym razem w Departamencie Policji w Anderson. Co ciekawe do tej pory technologia była wykorzystywana przez bardzo wyspecjalizowane jednostki, powołane np. do walki z gangami czy przemytem narkotyków, obecnie również Policja. A więc otwierają się kolejne ścieżki sprzedażowe.
Ale najciekawsze moim zdaniem jest tutaj, jeśli taka osoba poleca produkt Datawalk, to chyba wątpliwości na temat jego użyteczności powinny zupełnie wygasnąć.
„Miałam okazję zapoznać się z naprawdę wieloma dostawcami i produktami” - mówi dr Shelagh Dorn z wydziału analiz w Departamencie Policji Anderson, która pełni również funkcję prezesa Międzynarodowego Stowarzyszenia Analityków Organów Ścigania (IALEIA). „Technologia, produkt i ludzie związani z DataWalk zapewniają nam niesamowite możliwości analityczne i pełen wgląd w nasze dane. Nie możemy się doczekać pracy na tym systemie”
“Jesteśmy na etapie zdobywania referencji na rynku amerykańskim i z tej perspektywy współpraca z Departamentem Policji w Anderson ma dla nas szczególne znaczenie. Nie mogę wyobrazić sobie lepszej rekomendacji dla innych jednostek Policji niż pozytywna opinia szefowej International Association of Law Enforcement Intelligence Analysts” – mówi Paweł Wieczyński, prezes DataWalk SA.
I trudno się z tym stwierdzeniem nie zgodzić.
|
|
Temat:
PURE
Na rynku staram się specjalizować w startupach i uważam, że to właśnie one za kilka lat staną się hitem polskiego rynku w tym oczywiście m.in branża biotechnologiczna. Inwestorzy zagraniczni, którzy teraz inwestują w polskie nieruchomości lub kapitałem VC wchodzą w młode spółki niepubliczne wcześniej czy później wykorzystają dysproporcję pomiędzy swoim rynkiem a rynkiem polskim jak robili to w innych obszarach inwestycyjnych. Jak mówi Paweł Przewięźlikowski za nimi stoi 40 lat doświadczeń inwestowania w branże biotechnologiczną , nauczyli się jej, za polskimi inwestorami tylko kilka lat. To, ze tak się stanie , w moim przekonaniu jest wysoce prawdopodobne.
Jednak inwestowanie statystyczne, na zasadzie „wiem, że 1% startupów wychodzi, jak mi się uda i zarobię x50 jak nie to stracę ale i tak niewiele tego było” jest moim zdaniem błędną drogą, dla mnie osobiście nie do zaakceptowania. Jedynie wnikliwa analiza spółki w różnych obszarach daje możliwość przyjęcia prawdopodobieństwa sukcesu lub jego braku i jest do zaakceptowania przez poważnie działającego w tej dziedzinie inwestora. Po takiej analizie następuje najczęściej żmudny i długotrwały proces weryfikacji - sprawdzanie, sprawdzanie i jeszcze raz sprawdzanie : działań spółki, podejmowanych decyzji, przestrzegania harmonogramu, prawdomówności zarządu, realizacji określonych celów krok po kroku. A nie ma lepszego sposobu na sprawdzanie spółki X czy Y niż spotkania osobiste z zarządem, kto bywał na takich spotkaniach, w szczególności w małych spółkach, wie co mówię.
Dlatego , kto ma spółkę i może przyjechać niech przyjedzie. Im więcej inwestorów o różnorodnych kompetencjach będzie weryfikowało dany podmiot tym bardziej możemy ocenić czy to co robią jest sensowne czy też nie. Czy warto taką spółkę trzymać czy może lepiej spokojniej zainwestować w obligacje skarbowe :) . Ja na pewno będę.
|
|
Temat:
PURE
Dla zainteresowanych- informacja, o przyszłotygodniowym spotkaniu z Pure Biologics , którą otrzymałem z Innervalue. Szanowni Państwo,
w imieniu Zarządu Pure Biologics S.A. mamy przyjemność zaprosić na konferencję Spółki, podczas której omówione zostaną realizowane projekty innowacyjne oraz perspektywy rozwoju w najbliższych okresach.
W spotkaniu udział weźmie Prezes Pure Biologics S.A. dr Filip Jeleń.
Termin: 22 października (wt), godz. 17:00
Lokalizacja: Warszawa
Szczegóły zostaną przesłane zainteresowanym osobom. Informację dot. chęci uczestnictwa prosimy przesyłać do 21 września (pn) na adres purebiologics@innervalue.pl
Liczba miejsc ograniczona
|
|
Temat:
PURE
Temat jest dla dość niezwykły tj. oddanie własnych akcji przez Akcjonariuszy Założycieli celem realizacji Programu motywacyjnego. Jak sobie policzyłem dotyczy to aż 14,6% kapitalizacji spółki i ok. 26% akcji posiadanych przez Akcjonariuszy Założycieli. Żeby niepotrzebnie się nie rozwadniać, krótko : dla mnie taka postawa to objaw szacunku dla akcjonariuszy i potwierdzenie świadomości tego co stanowi największą wartość tego rodzaju spółki – ludzie i to najlepsi, trzeba ich przyciągać lub jeśli są zatrzymać i zmotywować. Wtedy spółka będzie miała prawdopodobieństwo uzyskania jak najlepszych efektów prac oraz uzyskania oczekiwanego wyniku, wycena eksploduje i wszyscy zarobią. To myślenie strategiczne i długofalowe niedostępne do zarządów większości spółek giełdowych a tu urealnione i zrealizowane. Brawo. infostrefa.com/infostrefa/pl/w...Elementem motywacyjnym Programu jest 241 000 akcji należących do Akcjonariuszy Założycieli, których własność na warunkach preferencyjnych zostanie przeniesiona na osoby wytypowane w ramach Programu Motywacyjnego (Uczestnicy). Akcjonariusze założyciele postanowili przeznaczyć na Program Motywacyjny akcje należące do nich, nie obciążając tym samym pozostałych akcjonariuszy Spółki………
Realizacja Programu Motywacyjnego wobec Uczestników odbywa się poprzez przeniesienie przez Dysponenta prawa własności przyznanej uczestnikowi liczby Akcji na warunkach preferencyjnych. Warunki preferencyjne oznaczają sprzedaż Akcji po ich cenie nominalnej. Program Motywacyjny realizowany będzie do końca 2021 r.
|
|
Temat:
DATAWALK
bankrucik napisał(a): "mocna zapowiedź  kasa z emisji pójdzie na sprzedaż" Zgodnie z zapowiedziami Prezesa na dniach otwartych. Zresztą dla mnie to też jedyna droga aby próbować stać się spółka globalną.
|
|
Temat:
PURE
|
|
Temat:
PURE
Bardzo dobry podcast pokazujący kulisy tworzenia i rozwijania spółki biotechnologicznej w Polsce. M.in. jaka jest różnica w finansowaniu podobnych firm w USA i Polsce oraz różnica pomiędzy inwestorem polskim inwestujących w biotechnologię a amerykańskim. Pouczająca dawka informacji i know-how dotycząca mechanizmów właściwie każdej spółki tego typu w Polsce, przekazywana przez człowieka, który niewątpliwie zna ten rynek znakomicie . Dla każdego kto bardziej chce zrozumieć branżę w której inwestuje. strefainwestorow.pl/21-rocznie...
|
|
Temat:
SCPFL
|
|
Temat:
PURE
Szykuje się spotkanie Pure w Warszawie dla inwestorów i analityków z funduszy- będę na pewno na tym spotkaniu. Macie jakieś pytania i zagadnienia które was nurtują, mogę je zadać i poprosić aby wcześniej przygotowali się do tematu. Jeśli coś takiego jest to dawajcie.
|
|
Temat:
DATAWALK
Emisja akcji na rzecz inwestorów instytucjonalnych infostrefa.com/infostrefa/pl/w...infostrefa.com/infostrefa/pl/w...Ta emisja, przynajmniej dla mnie, była przede wszystkim kwestią wiarygodności zarządu, który był bardzo pewien możliwości jej przeprowadzenia wśród inwestorów instytucjonalnych. I rzeczywiście, mamy raport. Umowy będą zawierane do 4.10. a więc po ich podpisaniu powinien pojawić się kolejny raport końcowy z całej emisji. Ale z grubsza licząc 327 tys. po 46 zł (wg. mnie to cena godziwa na dzisiaj) to ok. 15 mln zł, co pozwoli spółce odetchnąć i realizować spokojnie swój harmonogram
|
|
Temat:
DATAWALK
Dla ciekawych - zestawienie wszystkich patentów spółki. Tutaj jest dobra wyszukiwarka patentscope.wipo.int/search/en...wystarczy wpisać Krystian Piecko, pojawia się 20 zgłoszeń patentowych. Niektóre dotyczą tego samego tematu ale innych regionów świata. Co ważne (pytałem o to na dniu inwestora i rzeczywiście jest to tutaj potwierdzone) w każdym patencie aplikującym jest Datawalk a wcześniej PILAB), co czyni właścicielem praw z patentu spółkę a nie jego twórcę. Trzeba pamiętać, że zgłoszenia patentowe są publikowane po 18 miesiącach od daty pierwszego zgłoszenia (tzw. daty pierwszeństwa). Przez pierwsze 18 miesięcy są tajne (łącznie z faktem ich istnienia; o ile zgłaszający sam go nie ujawni). Co więcej, jeżeli zostaną wycofane przed upływem 18 miesięcy, to pozostają tajne na zawsze. A wiec nie wszystko widzimy co zostało zgłoszone i warto co kilka m-cy sobie odświeżyć temat.
|
|
Temat:
DATAWALK
Trzeba przyznać, że, przynajmniej na razie, robią to co obiecali z tempem godnym odnotowania. Ponadto wybicie oporu na 40 zł, który blokował wzrosty od początku 2016r też niewątpliwie przekłada się na pozytywny obraz spółki. Czekamy na informacje w jaki sposób pozyskają aktualne finansowanie i ile tego będzie (dla mnie to najbliższe miesiące). Ta ważna informacja, w moim przekonaniu, dopełni aktualną analizę spółki.
|
|
Temat:
PURE
Kolejny projekt rekomendowany do dofinansowania. "Opracowanie nowej metody terapeutycznej czerniaka opartej na nośniku aptamerowym" będzie realizowany w spółce z identyfikatorem PB006. Projekt będzie realizowany w konsorcjum. Co ciekawe, jest oparty na aptamerach i niewątpliwie rozwija praktyczne kompetencje spółki w tym zakresie. Ważne elementy : - Celem projektu PB006 są badania typu proof-of-concept (dowód koncepcji) - Do opracowania kandydata zostanie wykorzystana platforma Spółki do generowania modyfikowanych aptamerów - PureApta. - czas trwania projektu wynosi 18 m-cy - Całkowita wartość projektu wynosi 2 354 428,75 zł, a rekomendowana kwota dofinansowania z funduszy unijnych 2 072 126,75 zł. Budżet etapów projektu realizowanych przez Emitenta wynosi 1411 510,00 zł (koszt całkowity), a rekomendowana kwota dofinansowania wynosi 1 129 208,00 zł. Wkład własny projektu całym okresie jego realizacji Emitent zamierza pokryć w pierwszej kolejności z kapitału pozyskanego w ramach przeprowadzonej emisji akcji serii D, a następnie w ramach przyszłych emisji akcji. - Projekt będący trzecim w portfelu projektów terapeutycznych opartych o wykorzystanie własnościowej platformy generowania aptamerów Pure Biologics S.A. realizowany będzie w latach 2020-2021. Link do raportu infostrefa.com/infostrefa/pl/w...
|
|
Temat:
SCPFL
Analiza startupów to stosunkowo młoda "nieodkryta" dziedzina inwestycyjna. Realne szacowanie ryzyk i szans dla młodej spółki , która zazwyczaj nigdy jeszcze nie sprzedała swojego produktu a dopiero zamierza, to bardzo specyficzne i trudne zadanie, mówiąc wprost zazwyczaj niedostępne dla inwestora opartego na tradycyjnych metodach analizy. Jednak Analityk Fundamentalny kolejny raz dowiódł, że można to zrobić i to zrobić bardzo dobrze. Bardzo uważnie czytałem jego test i naprawdę chciałbym polemizować ale nie mogę, bo nie wiedziałbym z czym. To kolejna dobra analiza tego rodzaju spółki wychodząca spod pióra Analityka Fundamentalnego i pewnie będzie on bardzo niezadowolony brakiem podjęciem jakiekolwiek dysputy, przynajmniej z mojej strony, ale niestety nie tym razem. Dobra robota, gratulacje.
|
|
Temat:
DATAWALK
Z chęcią wytłumaczę. Moje spojrzenie na weryfikację starupu - dla mnie tego rodzaju spółka to nie statystyka, to nie sięganie pamięcią w podmioty, które oszukały, okazały się nieudolne lub odniosły sukces – to analiza ryzyka tu i teraz w tym konkretnym podmiocie. Analiza doświadczeń ludzi biorących w nim udział, analiza realizacji założonego harmonogramu, racjonalności podejmowanych decyzji i tysiąca elementów rzetelnej oceny takiego podmiotu. I na końcu i najważniejsze – sprawdzanie, sprawdzanie i jeszcze raz sprawdzanie tego co robią i jak robią. Na końcu tego wszystkiego pojawia się konkretne ryzyko decyzji inwestycyjnej, czy posiadanych akcji. To setki godzin analizy, rozmów z zarządem (do startupow jest stosunkowo łatwy dostęp), wyjazdów, dużego zaangażowania.
Oczywiście mogę w części nie mieć racji, mogę wchodzić w drogi inwestycyjne i się z nich po jakimś czasie wycofywać (jak to już bywało nie raz), weryfikować swoje przekonania, przyznawać się do błędów, ale na dzisiaj moje spojrzenie jest takie jak powyżej i to jest realny mój warsztat pracy.
|
|
Temat:
DATAWALK
Nie chciałbym się tutaj przepychać, nie mam na to kompletnie czasu. Nie interesuje mnie mieć rację i zawsze ostatnie słowo, to już dawno zostawiłem za sobą. A konkretnie : ta ironia byłaby o wiele mniejsza, gdybyś ze zrozumieniem przeczytał to co napisałem "analiza dynamiki i ilości podpisywanych kontraktów w odniesieniu do przyjętej strategii i w ten sposób ocena prawdopodobieństwa sukcesu"- czyli tego co się dzieje w realu a ty odniosłeś do przewidywań "pochodną prognozowanej ilości przyszłych klientów". To zupełnie dwie różne rzeczy.
|
|
Temat:
DATAWALK
W przypadku tego modelu biznesowego absolutnie nie chodzi o zysk, ta spółka prawdopodobnie do exitu nigdy nie będzie rentowna. Ponieważ każde pieniądze zostaną przekute w budowanie struktury sprzedażowej w USA. Tu chodzi o zdobycie olbrzymiej ilości klientów (stopniowo zgodnie ze strategią) i docelowo utrwalenie stosowania technologii przez firmy jako naturalna alternatywa dla Palantira (który zresztą do dzisiaj nie jest rentowny). Wtedy exit tzn. sprzedaż.
Wiara tu nie ma nic do rzeczy, to zimna analiza dynamiki i ilości podpisywanych kontraktów w odniesieniu do przyjętej strategii i w ten sposób ocena prawdopodobieństwa sukcesu.
|
|
Temat:
DATAWALK
Wczoraj brałem udział w Dniu Inwestora w siedzibie Datawalk we Wrocławiu. Dla mnie, po tym spotkaniu, potwierdza się idea znakomitego produktu, zresztą potwierdzana również wcześniej przez wiele ważnych i poważanych w środowisku osób. Ale produkt to nie wszystko a więc powstaje pytanie czy im się uda ? I tu wchodzi kilku tematów :
- finansowanie – to główna myśl : na budowanie na rynku amerykańskim zespołów sprzedaży, wg. Prezesa „na teraz” powinno być to zaspokojone przez obecną emisje dla obecnych akcjonariuszy, potem jak rozumiem coraz to nowe kontrakty , budowanie wiarygodności i wtedy być może mocniejsze i szersze finansowanie. Dla mnie brak finansowania = brak rozwoju ustalonej strategii biznesowej, a wiec ten temat powinien być najmocniej monitorowany przez zainteresowanych inwestorów
- czy ci ludzie mogą to zrobić ? – moim zdaniem tak, ekipa w Polsce bardzo kompetentna i profesjonalna, zarząd, sprzedaży, marketing, wszyscy wiedzą co muszą robić i robią to bardzo dobrze i profesjonalnie. USA doświadczeni sprzedawcy znający realia rynku, inteligentna strategia sprzedaży, aby np.: małymi kroczkami za 100 tys usd przyzwyczaić klienta do produktu. Konsorcja z innymi firmami, wchodzenie w duże tematy, gdzie sami nie mieli by szans. Małymi krokami włamywanie się na ten rynek, zdobywanie przyczółków, świadomi zagrożeń i ryzyk, które Gabe Gotthard wymienił i omówił kilkanaście zaraz na drugim i trzecim slajdzie swojej prezentacji. Ryzyko blokowania przez Palantir (w które zainwestowała inwestycyjna odnoga CIA) , no oczywiście , ze tak, ale mówimy o młodej firmie , która wpycha się na ten rynek i te ryzyka są oczywiście, ale moim zdaniem są w cenie.
Co w tym wszystkim dobrego- to elementy sprawdzające dla każdego inwestora tj. łatwość do sprawdzania realizacji strategii, piloty, przerodzone w kontrakty itp, wzrost przychodów 70 lub 100% r/r. Krok za krokiem realizowanie strategii, wiarygodność tego co mówią, robią i jak im się to udaje.
Jeśli wszystko pójdzie zgodnie z planem , exit jako globalna firma realistycznie po 2024 a może i później. Jeśli nie (np.: zabraknie finansowania), sprzedaż wcześniejsza dla, któregoś z wielkich graczy. Dla mnie, długoterminowe prawdopodobieństwo straty, na tej firmie, osobiście oceniam jako niewielkie, w skrajnym przypadku zarobek będzie niewielki,
Po tym spotkaniu dla mnie percepcja bez zmian, oczywiście po przyszłym udanym finansowaniu rynek może ruszyć do góry, ale osobiście dla mnie to nic nie znaczy, ponieważ ja oceniam spółkę na long i to długi....
|
|
Temat:
DATAWALK
Jeśli ktoś inwestuje w startup jakim jest bez wątpienia DataWalk, bez spotkania z ludźmi go tworzącymi to, w moi przekonaniu, jest to duży błąd. Lepiej już zagrać w zdrapkę, może coś się uda...
Bezpośrednie spotkanie, zadawanie pytań, obserwacja tego co odpowiadają i jak odpowiadają (a na takie spotkania przyjeżdżają inwestorzy naprawdę znający temat i potrafiący pytać dogłębnie) to dla mnie część obowiązkowej analizy takiej spółki. Wiadomo, ze trzeba poświecić dzień, przyjechać do Wrocławia i że zawsze to kwestia wyboru. Ale dla mnie czy warto na takie spotkania jeździć jest poza dyskusją.
|
|