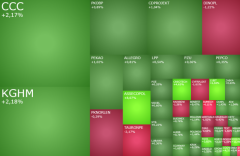
Celon Pharma pozytywnie ocenia spotkanie z FDA w sprawie CPL’36 w schizofrenii (Fot. materiały prasowe)
FDA potwierdziła kierunek rozwoju CPL’36
Podczas spotkania typu B z 1 października, którego podsumowanie spółka otrzymała dzień później, Food and Drug Administration (FDA) oceniła dane dotyczące dotychczasowych badań przedklinicznych i klinicznych CPL’36 oraz zaakceptowała planowany dalszy rozwój projektu w schizofrenii.
– W dniu 2 października 2025 r. spółka otrzymała podsumowanie dotyczące spotkania typu B z dnia 1 października 2025 r, zawierające odpowiedzi na pytania z zakresu spotkania łączonego pre-IND meeting oraz End-of-Phase 2. W trakcie spotkania dyskutowano na temat przeprowadzonych oraz kontynuowanych przez spółkę badań przedklinicznych, jakościowych oraz klinicznych CPL’36. Głównym jego celem było uzyskanie opinii FDA na temat zakresu dotychczas otrzymanych danych i akceptacja zaproponowanego dalszego rozwoju nieklinicznego i klinicznego kandydata na lek inhibitora PDE10A, CPL’36 w leczeniu schizofrenii, w ramach planowanej III fazy badań klinicznych – czytamy w komunikacie.
Zakres ustaleń z FDA
Agencja potwierdziła adekwatność dotychczasowych badań toksykologicznych oraz zasadność programu przedklinicznego. FDA zapoznała się także z wynikami fazy I i II, wskazując na możliwość kontynuacji rozwoju klinicznego. Uznano również, że proponowany kierunek projektowania badań III fazy jest właściwy, a wskazanie rejestracyjne „leczenie schizofrenii” – adekwatne.
FDA zasugerowała szczegóły dotyczące kryteriów włączania pacjentów do badań, oceniła punkty końcowe oraz wskazała dokumenty, jakie należy dołączyć do wniosku o rozpoczęcie badań fazy III.
Wpływ ustaleń na dalsze działania Celon Pharma
Spółka poinformowała, że uwzględni zalecenia FDA przy przygotowywaniu finalnych protokołów badań fazy III i przekaże wyniki spotkania potencjalnym partnerom w procesie komercjalizacji projektu CPL’36.
– Zarząd spółki ocenia spotkanie jako bardzo korzystne. Agencja wyraziła zgodę na szereg ułatwień zmierzających do skrócenia czasu prowadzenia projektu i zmniejszenia kosztów planowanych badań do uzyskania dopuszczenia produktu do obrotu – podano w materiale.
Formalny status decyzji FDA
Celon podkreślił, że stanowisko FDA nie oznacza jeszcze zgody na rejestrację produktu. Jest to jednak istotny etap przygotowań do badań klinicznych fazy III i późniejszego złożenia wniosku rejestracyjnego NDA (New Drug Application). Agencja podejmie ostateczne decyzje dopiero po analizie dokumentacji i danych, które spółka złoży wraz z wnioskiem.
Celon Pharma to zintegrowana firma biofarmaceutyczna, działająca w obszarze badań, rozwoju, produkcji i sprzedaży leków. Spółka debiutowała na rynku głównym GPW w 2016 r. i wchodzi w skład indeksu sWIG80.