Szykuje się kolejne IPO. KNF zatwierdziła prospekt PolTREG-u
We wtorek na łamach StockWatch.pl informowaliśmy, że blisko debiutu na GPW jest PolTREG. Dziś spółka potwierdziła plany i zapowiedziała na czwartek publikację prospektu emisyjnego, zatwierdzonego właśnie przez KNF.
Z wcześniejszych doniesień prasowych wynika, że PolTREG planuje pozyskać ponad 130 mln zł brutto i przeznaczyć je kontynuację badań klinicznych w obszarze cukrzycy typu 1, stwardnienia rozsianego oraz Treg 2.0, a także budowę własnego laboratorium.
– Zamierzamy pozyskać kapitał w celu jak najszybszego ukończenia badań klinicznych i zaoferowania naszych terapii pacjentom. Widzimy, że nasze terapie mogą dać szansę chorym, w tym dzieciom, cierpiącym na choroby, na które obecnie nie ma skutecznych leków – mówił niedawno prezes, współzałożyciel i akcjonariusz PolTREG prof. dr. hab. n. med. Piotr Trzonkowski.
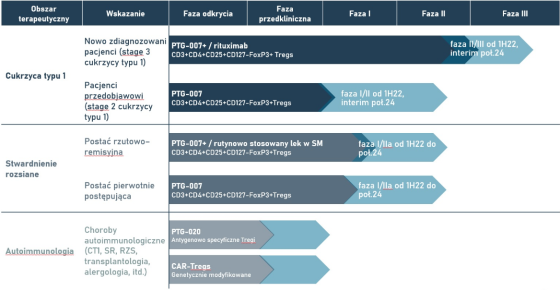
PolTREG to firma biotechnologiczna rozwijająca terapie z wykorzystaniem komórek T-regulatorowych (TREGS) na zaawansowanym etapie klinicznym, które celują w potrzeby medyczne w obszarze autoimmunologii – m.in. leczenie cukrzycy typu 1 oraz stwardnienia rozsianego. Spółka realizuje obecnie na różnym etapie zaawansowania dwie główne grupy projektów badawczo-rozwojowych (terapii cukrzycy typu 1 u dzieci oraz stwardnienia rozsianego) stanowiące platformę do opracowania skutecznych i innowacyjnych terapii na różne choroby autoimmunologiczne oraz projekt rozwoju platformy Treg 2.0.
Prace nad wykorzystaniem TREGS w leczeniu cukrzycy typu 1 rozpoczęły się jeszcze w 2006 r. na Gdańskim Uniwersytecie Medycznym i były prowadzone m.in. przez założycieli i znaczących akcjonariuszy spółki: prof. dr. hab. n. med. Piotra Trzonkowskiego, prof. dr. hab. n. med. Małgorzatę Myśliwiec oraz prof. dr. hab. n. med. Natalię Marek-Trzonkowską. Prowadzone w kolejnych latach badania wykazały skuteczność opracowanych rozwiązań, co doprowadziło do powstania spółki PolTREG w 2015 roku jako spin-off z Gdańskiego Uniwersytetu Medycznego, której celem jest prowadzenie etapów badań klinicznych, opracowywanie nowych terapii, a także komercjalizacja rozwiązań.
Spółka zakończyła w 2015 roku I fazę badań klinicznych w cukrzycy typu 1 u dzieci, a w 2020 roku zakończyło się badanie fazy I/II. Obecnie po procedurze Scientific Advice z Europejską Agencją Leków (EMA) w przygotowaniu jest badanie fazy II/III w leczeniu pacjentów ze świeżo zdiagnozowaną cukrzycą typu 1. Drugim badaniem w cukrzycy typu 1 będzie badanie I/II polegające na identyfikacji i leczeniu pacjentów w okresie przedobjawowym. W ramach tego badania spółka zamierza przeprowadzić badanie wśród pacjentów, które ze względu na uwarunkowania genetyczne są w grupie wysokiego ryzyka zachorowania na cukrzycę typu 1. Jak zaznacza spółka, to badanie może otworzyć zupełnie nowy rozdział w podejściu do tej choroby, bowiem obecnie ze względu na brak dostępnego leczenia nie prowadzi się badań przesiewowych i leczenia na wczesnym etapie rozwoju choroby. Upowszechnienie badań przesiewowych, pozwalających na szybkie zdiagnozowanie choroby i rozpoczęcie leczenia będzie istotne dla zastosowania terapii cukrzycy typu 1 w fazie przedobjawowej.
Spółka zakończyła także z obiecującymi wynikami fazę I badania klinicznego w rzutowo-remisyjnej postaci stwardnienia rozsianego.