Biotechnologia na giełdzie. Jak giełdowe spółki zarabiają na lekach i patentach
Chciałbym jednak wyraźnie podkreślić, że nie jestem ani farmaceutą ani nie posiadam wykształcenia medycznego i jest to tylko i wyłącznie moje zrozumienie pewnych ogólnych informacji dotyczących leków i szerzej całego rynku oraz procesu powstawania leków. Moja wiedza jest oczywiście oparta zarówno na prezentacjach firm biotechnologicznych, farmaceutycznych jak i rozmowach z zarządami spółek giełdowych wsparta kilkuletnim doświadczeniem inwestycyjnym w tym obszarze.
Leki innowacyjne i nie tylko
Zrozumienie procesu powstawania leków pozwolę sobie zacząć od krótkiej charakterystyki ich typów wraz z opisaniem podstawowych różnic. Proszę spojrzeć na poniższy wykres, gdzie widzimy dwa rodzaje: tzw. małą cząsteczkę oraz leki biologiczne.
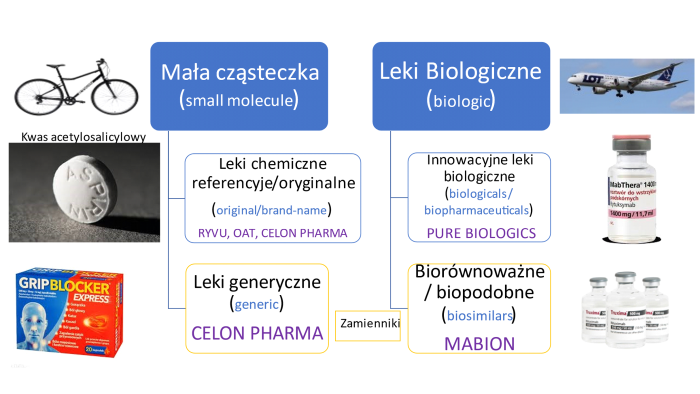
Rys. 1. Opracowanie własne
Ktoś kiedyś przyrównał różnicę miedzy lekami chemicznymi a biologicznymi do różnicy między rowerem składającym się pewnie z około 100-150 części i samolotem, gdzie części liczone są w dziesiątkach tysięcy. Podobne porównanie również występuję w opisywanym przeze mnie obszarze. Weźmy dla przykładu lek chemiczny, dobrze nam znany kwas acetylosalicylowy (popularna aspiryna), który składa się z 21 atomów (9 atomów węgla, 8 atomów wodoru i 4 atomów tlenu). Dla porównania lek biologiczny, którym jest przeciwciało IGg zawiera w sobie już ok. 25 tys. atomów.
Leki chemiczne oryginalne (referencyjne) zarejestrowane na podstawie kompletnej dokumentacji rejestracyjnej. Jest to lek zarejestrowany w oparciu o udokumentowaną skuteczność terapeutyczną, bezpieczeństwo stosowania i jakość. Leki te posiadają oryginalną, niepowtarzalną recepturę i zawierają aktywny składnik leczący. Leki chemiczne charakteryzują się względnie prostą strukturą cząsteczkową (przynajmniej w porównaniu do leków biologicznych) i otrzymywane są drogą syntezy chemicznej. Stąd też często określane są mianem tzw. małej cząsteczki, czyli small molecule.
Przykładem spółek, które zajmują się produkcją tego typem leków są np. Ryvu Therapeutics (rozwój innowacyjnych małocząsteczkowych związków o potencjale terapeutycznym w onkologii), Onco Arendi Therapeutics (odkrywanie i rozwijanie cząsteczek pomagających leczyć raka, choroby włóknieniowe czy zapalne) czy częściowo Celon Pharma (prace w zakresie cząsteczek nakierowanych na terapie onkologiczne, neuropsychiatrię i choroby zapalne).
Leki chemiczne generyczne (czasami również określane mianem odtwórczych) zarejestrowane na podstawie odwołania do wyników badań klinicznych i toksykologicznych leku referencyjnego oraz przedstawienia wyników badań biorównoważności z lekiem referencyjnym. Substancja czynna w zasadzie jest identyczna jak w leku chemicznym. Są to innymi słowy zamienniki leków oryginalnych, mające te same substancje czynne, jak i działanie farmakologiczne, co leki oryginalne.
Czasami pojawia się również pojęcie leki generyczne plus – przykładem może być tutaj np. Salmex produkowany przez Celon Pharmę (wspomnianą już przy lekach oryginalnych), który posiada tę samą substancję czynną co lek referencyjny, ale różni się sposobem podawania – jest to lek wziewny – aplikowany pacjentom za pomocą inhalatora. Leki te, jako zamienniki, nie mogą być wprowadzone do obrotu do momentu wygaśnięcia ochrony patentowej leku referencyjnego.
Lek biologiczny jest to lek wytwarzany z żywego organizmu lub z jego fragmentu, w przeciwieństwie do leku nie biologicznego, który jest syntezowany w procesie chemicznym. Mówiąc bardziej przystępnym językiem, substancja czynna leku biologicznego została wytworzona przez żywe komórki hodowane in vitro. W większości leki biologiczne są dużymi cząsteczkami białkowymi. Leki biologiczne określamy też często mianem dużej cząsteczki – to właśnie ta różnica między samolotem a rowerem – zdecydowana większość tych leków charakteryzuje się złożoną budową.
Reprezentantem tego segmentu leków na polskiej giełdzie może być spółka Pure Biologics, która działa w obszarze immunoonkologii, autoimmunologii oraz neurologicznych chorób rzadkich.
Leki biopodobne są produktami naśladującymi już zarejestrowane innowacyjne leki biologiczne. Synteza białek w żywych komórkach może ulegać pewnym zmianom. Tym samym możliwe są pewne różnice w budowie leków. To też oznacza, że w praktyce stworzenie leku biopodobnego nie jest takie proste i w uproszczeniu można przyjąć, że jest trudniejsze niż leku generycznego chemicznego, gdzie znamy wzory chemiczne i można je odwzorować. Obydwa leki (oryginalny biologiczny oraz biopodobny) różnią się składem (na ich wartość terapeutyczną wpływa każdy proces elementu wytwarzania) – są to w efekcie końcowym dwie różne cząsteczki (różne produkty lecznicze), które jednak mają to samo wskazanie lecznicze i podobny profil jakościowy oraz działania jako cząsteczka. Lek biopodobny powinien być jak najbardziej podobny do referencyjnego leku biologicznego i nie powinien wykazywać klinicznie znaczących różnic. Ze względu na specyfikę procesu produkcyjnego i faktu, że leki biologiczne to często duże, złożone cząsteczki, nie oczekuje się jednak, że będzie to dokładnie kopia leku biologicznego – jak to się dzieje w wypadku chemicznych leków generycznych. W wypadku leków biopodobnych, które de facto są nowym produktem, już tak nie jest. Producent musi udowodnić, że produkt uzyskiwany w nowo zaprojektowanym procesie ma takie same efekty terapeutyczne, poziom bezpieczeństwa i efekty uboczne jak oryginalny lek biologiczny. To prowadzi do konieczności dużej liczby badań laboratoryjnych oraz klinicznych, co oczywiście podwyższa budżet kosztowy i wydłuża harmonogram projektu. Mabion, który wciąż walczy z rejestracją swojej cząsteczki CD20 jest właśnie przykładem giełdowej spółki zajmującą się takim typem leków.
Podsumowując, leki można podzielić na innowacyjne (leki oryginalne tzw. małe cząsteczki oraz leki biologiczne) oraz ich naśladowców (czyli leki generyczne oraz biopodobne). Leki generyczne (ze względu na prostszą budowę chemiczną) w zasadzie można powiedzieć, że są identyczne z lekami oryginalnymi/referencyjnymi. Leki biopodobne to leki podobne do już istniejącego leku biologicznego, lecz jednak nie można tutaj mówić o pełnej 100 proc. zgodności z referencyjnym lekiem biologicznym.
Z punktu widzenia inwestora warto zapamiętać, że już sam powyższy opis rodzajów leków dość wymownie wskazuje na większe szanse na duże przychody i zyski w wypadku leków oryginalnych (chemiczne referencyjne i biologiczne) niż zamienników (leki generyczne/odtwórcze oraz leki biopodobne). Związane jest to oczywiście z faktem zajęcia pierwszego miejsca na rynku w danym momencie, możliwości ustalania ceny sprzedaży bez oglądania się na konkurencję oraz korzystania z ochrony patentowej przez dość długi czas. W momencie wprowadzenia na rynek leku generycznego ceny zazwyczaj istotnie spadają, co oczywiście jest związane z pojawieniem się konkurencji. Oczywiście, aby nie było tak prosto, to zdecydowanie trudniej jest wynaleźć lek innowacyjny, przejść przez wszystkie fazy rozwoju, uzyskać zezwolenia i skutecznie wprowadzić go na rynek, niż w wypadku leku generycznego, choć tam też nie jest to takie proste i łatwe.
Uwarunkowania prawne – patenty
Jak zobaczymy później, choć zapewne już wiemy albo się domyślamy, wynalezienie leku to dość kosztowna i czasochłonna operacja obarczona zresztą dość istotnymi ryzykami niepowodzenia na wielu etapach tego procesu. Stąd też naturalnym wydaje się konieczność zapewnienia pewnej gwarancji prawnej, aby konkurenci zbyt szybko nie mogli skopiować rozwiązania, czyli po prostu ochrony patentowej.
Prowadzenie działalności przez producentów leków generycznych jest po prostu prostsze, krótsze i co za tym idzie tańsze. Zazwyczaj nie wymaga przeprowadzania wieloletnich badań klinicznych jak w wypadku leków oryginalnych, których kosztów nie muszą następnie odzyskiwać poprzez sprzedaż leków o wysokiej cenie. Dzięki temu leki generyczne najczęściej są znacznie tańsze od ich leków referencyjnych dostępnych na rynku.
Ochrona patentowa ma stanowić bodziec dla przemysłu farmaceutycznego, aby inwestować duże pieniądze w badania nad nowymi lekami. Zapewnienie wyłączności rynkowej pozwala oczywiście dyktować wyższe ceny i zapewnić rentę patentową, czyli zwrot z inwestycji oraz pozyskać środki na przeprowadzanie badań nad kolejnymi lekami/terapiami.
Ochrona patentowa na leki trwa zazwyczaj 20 lat, lecz tutaj istotna uwaga – punktem startowym nie jest moment wprowadzenia leku na rynek, ale data zgłoszenia danego leku/cząsteczki w urzędzie patentowym. Proces odkrywania leku trwa kilka-kilkanaście lat, a cząsteczki patentuje się np. na etapie rozwoju przedklinicznego, więc efektywny okres ochrony patentowej jest zazwyczaj zauważalnie krótszy. Tak naprawdę może to być zaledwie połowa tego okresu.
Stąd też spółki mogą występować o tzw. dodatkowe świadectwo ochronne (SPC – Supplementary Protection Certificate), które pozwala przedłużyć ochronę. Świadectwo to zaczyna obowiązywać po upływie terminu ochrony patentowej i trwa przez czas równy okresowi, który upłynął między datą dokonania zgłoszenia do rejestracji patentowej a datą zezwolenia na wprowadzenie leku do obrotu pomniejszony o 5 lat. Obliczony w ten sposób czas trwania dodatkowej ochrony patentowej nie może przekroczyć 5 lat. Biorąc pod uwagę fakt, że spółki często dość wcześniej zgłaszają cząsteczki do opatentowania i okres stworzenia leku jest dość długi możemy przyjąć dla uproszczenia, że zazwyczaj będzie to właśnie 5 lat dodatkowej ochrony.
Dodatkowo spółki korzystają również z wyłączności na ochronę danych i wyłączność rynkową (ang. data, market exclusivity), które również pomagają w praktyce w utrzymaniu monopolu na danym rynku na dany produkt w danym okresie czasu. W Unii Europejskiej w efekcie wyłączności rynkowej lek referencyjny przez ściśle określony czas (zazwyczaj 10-11 lat) ma faktyczny i prawny monopol na tym rynku. W praktyce przekłada się to na niemożność wprowadzenia do obrotu w tym okresie leku generycznego w stosunku do leku referencyjnego. Okres ten liczy się od dnia wydania pozwolenia do dopuszczenie leku oryginalnego do obrotu.
Natomiast wyłączność danych polega na tym, że przez dany okres (wg dyrektywy europejskiej minimum 8 lat) firma wnioskująca o zatwierdzenie generycznego leku nie może skutecznie ubiegać się o jego rejestrację z powołaniem na dokumentację leku referencyjnego/oryginalnego. Okres wyłączności danych liczy się od momentu wydania pozwolenia na dopuszczenie do obrotu, W wypadku leków dopuszczonych na rynek amerykański okresy te są trochę inne – np. 12 lat dla market exclusivity i 4 lata dla data w wypadku leków biologicznych, ale jeśli chodzi o szczegóły to zachęcam już do własnych poszukiwań.
Oczywiście spółki, którym udało się opatentować leki innowacyjne nie chcą łatwo oddawać pola i rynku swoim konkurentom i stosują różnego rodzaju dodatkowe mniej lub bardziej skuteczne oraz etyczne rozwiązania, które mają skutkować wydłużeniem okresu, w którym zajmują one monopolistyczną pozycję na rynku. Przykładem może być tworzenia klastrów/gąszczy patentowych (patent clusters), co oznacza dużą liczbę zgłaszanych patentów w zasadzie do tego samego leku. Podnosi to u konkurencji stan niepewności w kontekście wystąpienia sporów patentowych czy podwyższa koszty badania czystości patentowej. Producenci leków referencyjnych czasami również próbują wprowadzić ulepszenia do swoich oryginalnych leków i uzyskiwać kolejne wyłączności i nowe patenty lub stać się producentem leku generycznego (czy biopodobnego). W końcu nie tak rzadko zdarza się, że duże firmy korzystające z ochrony patentowej wchodzą w spory prawne (pytanie czy w dobrej wierze pozostawia otwartym) z mniejszymi podmiotami, chcącymi wprowadzić leki generyczne na rynek, co czasami kończy się ugodami między dwoma stronami takiego sporu. Niewątpliwie jak widać powyżej uwarunkowania prawne są jednym z istotnych aspektów przy ocenie szans powodzenia i odniesienia sukcesu przez spółkę biotechnologiczną.
O całym procesie odkrywania leku napiszę jeszcze całkiem sporo w kolejnych artykułach, ale teraz chciałbym jeszcze wrócić do leków generycznych czy zamienników. Leki te są bardzo kochane przez płatników takich jak NFZ czy ich odpowiedniki z innych krajów na świecie. Rzut oka na poniższy wykres nie pozostawia złudzeń dlaczego tak się dzieje.
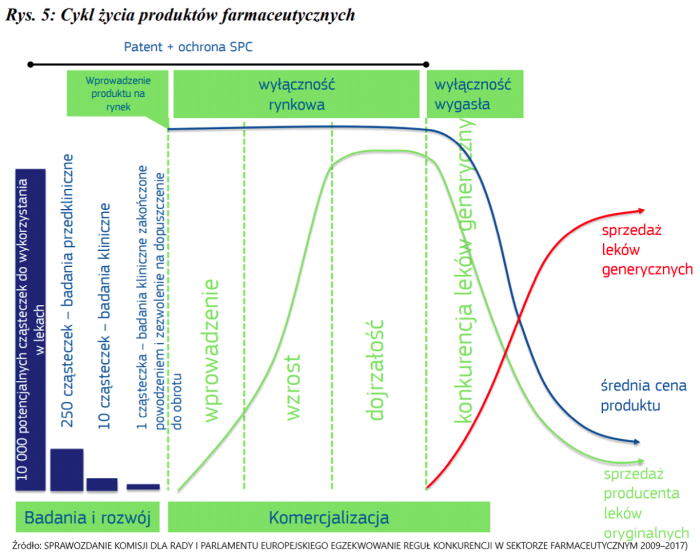
Cykl życia produktów farmaceutycznych. Źródło: Sprawozdanie Komisji dla Rady i Parlamentu Europejskiego egzekwowanie reguł konkurencji w sektorze farmaceutycznym 2009-2017
Proszę zwrócić uwagę na granatową linię pokazującą średnią cenę produktu farmaceutycznego. W okresie wyłączności rynkowej jest ona zazwyczaj stała (choć można założyć, że jednak pod koniec okresu dojrzałości rynkowej zaczyna spadać) i bardzo wysoka. Cechą charakterystyczną firm farmaceutycznych jest ich wysoki poziom innowacyjności, który z kolei wiąże się z istotnymi nakładami pieniężnymi. Kwota, jaką firmy ponoszą przy opracowaniu i wprowadzeniu na rynek jednego leku idzie zazwyczaj w setki milionów (często nawet w miliardy dolarów czy euro) a przecież w trakcie są również projekty, które okazują się nieudane i trzeba ich zaniechać. Stąd też wprowadzenie leku po wieloletnich badaniach musi zapewnić zwrot olbrzymich nakładów inwestycyjnych, co jednocześnie jest uzasadnieniem wysokich ceny innowacyjnych produktów leczniczych na rynku farmaceutycznym.
Z kolei w momencie gdy wyłączność na patent wygasa i pojawia się konkurencja (niekoniecznie od razu po wygaśnięciu patentu jak opisałem wcześniej), to cena produktu naturalnie zaczyna spadać, a wolumen sprzedawanych leków generycznych (czerwona linia) zaczyna zauważalnie rosnąć. Na przykład w Polsce zgodnie z ustawą refundacyjną, pierwszy lek generyczny, który wchodzi na krajową listę refundacyjną musi być o 25 proc. tańszy od leku referencyjnemu, któremu skończyła się ochrona patentowa. Oczywiście, nie trudno sobie wyobrazić, że również kolejne leki chcąc się dostać na taką listę (a to zazwyczaj ma konkretne przełożenie na wolumeny sprzedażowe) muszą się czymś wyróżnić. A czym się można wyróżnić, skoro skład jest taki sam – odpowiedź jest dość banalna – jeszcze niższą ceną. W uproszczeniu można przyjąć, ze wprowadzenie zamienników w perspektywie kilku lat powoduje zauważalny spadek ceny leku nawet o połowę. I tutaj mamy rozwiązaną zagadkę dlaczego właśnie płatnicy tak kochają leki generyczne czy biopodobne. Po prostu umożliwiają one zastosowanie terapii lekowych dla szerszej grupy ludzi przy niezmienionych lub wręcz niższych nakładach finansowych.
Dla inwestorów z powyższej informacji płynie kolejna ważna informacja. To jak szybko w porównaniu do konkurencji spółka wprowadzi do swojego portfolio lek (nawet jeśli to będzie „tylko” lek generyczny) ma istotne znaczenie. Jest to po prostu związane z faktem spadku średniej ceny leku w okresie czasu, a co za tym idzie oczywiście uzyskiwanych marż.
Idealnym przykładem może być tutaj Mabion, który po swoich perypetiach z rejestracją cząsteczki CD20 w chwili obecnej jest w okolicach 4-5 miejsca jako zamiennik leku biologicznego Mabthera od Roche i przecież wciąż nie wprowadził produktu na rynek. Niestety dla Mabionu (ale oczywiście na plus dla chorych) dwóch jego konkurentów (Celltrion/Truxima oraz Sandoz/Rixathon) z powodzeniem sprzedaje już swoje leki biopodobne i odbiera rynek Mabtherze. Jeśli więc nawet Mabionowi uda się w końcu zarejestrować swój lek i wprowadzić go do sprzedaży, to jednak wejście na rynek i uzyskanie satysfakcjonujących cen sprzedaży będzie sporo trudniejsze niż np. rok czy dwa lata temu. Proszę zresztą spojrzeć na kolejne dwa slajdy. Prezentują one pewne statystyczne miary (średnią oraz medianę) udziałów rynkowych na rynku leków po dopuszczeniu do obrotu zamienników.
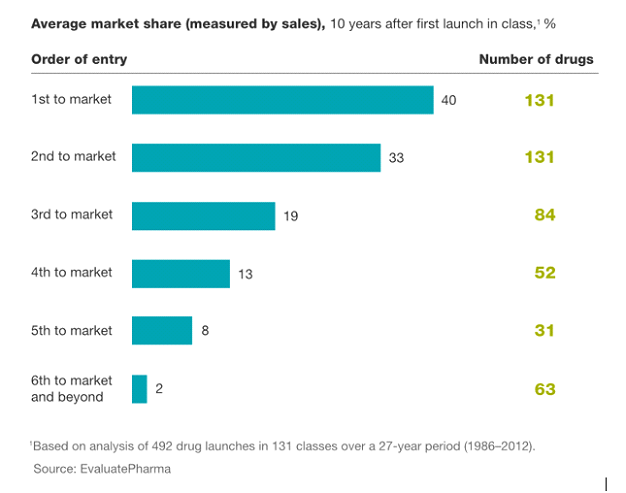
Statystyczny podział rynku (dla przebadanych 492 leków o sprzedaży rocznej powyżej 100 mln USD) pomiędzy najważniejszych graczy w 10 lat po wprowadzeniu leku.
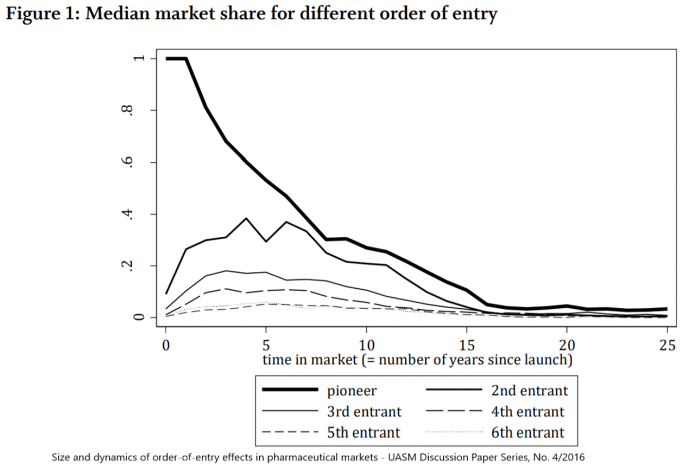
Mediana udziału w rynku dla różnych okresów dla pierwszych 6 graczy na rynku
Oczywiście trzeba pamiętać, że są to tylko pewne dane statystyczne, które nie muszą odpowiadać danemu konkretnemu przypadkowi, który wystąpi w przyszłości. W pierwszym wypadku slajd pochodzi z artykułu konsultingowej firmy McKinsey z 2014 roku. Jest tam opisany statystyczny podział rynku (dla przebadanych 492 leków o sprzedaży rocznej powyżej 100 mln USD) pomiędzy najważniejszych graczy w 10 lat po wprowadzeniu leku. Szacuje się, że 5 pozycja na rynku (czyli czwarty w kolejności zamiennik) koniec końców uzyskuje poniżej 10 proc. całego rynku, podczas gdy pierwszy zamiennik (czyli drugi lek na rynku) średnio przejmuje około 1/3 rynku.
Podobne wnioski można wyciągnąć z analizy zaprezentowanej w 2016 roku przez Uniwersytet Nauk Stosowanych w Moguncji, która jest pokazana na drugim slajdzie. Widzimy tam medianę udziału w rynku dla różnych okresów dla pierwszych 6 graczy na rynku. Wydaje się, że również ta analiza potwierdza istnienie efektu kolejności wejścia na rynkach farmaceutycznych co oznacza, że podmioty wchodzące na rynek wcześniej rzeczywiście są nagradzane wyższymi udziałami w rynku. Co ciekawe analizując zachowanie w czasie wydaje się, że korzyści te nie muszą się utrzymywać w długim (kilkunastoletnim) okresie czasu.
Leki Innowacyjne – ile ich jest
Kończąc ten artykuł zwrócić chciałbym jeszcze uwagę na liczbę leków roczne zatwierdzanych przez FDA (Food and Drug Administration – Agencja Żywności i Leków) i dopuszczanych na rynek amerykański.
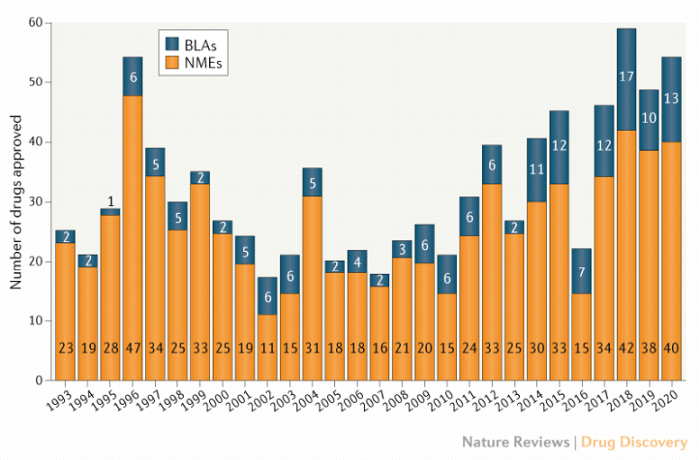
Liczba zatwierdzanych pozycji przez CDER (Center for Drug Evaluation and Research) w ciągu ostatnich 28 lat
Wykres pokazuje historię ostatnich 28 lat i jak widać liczba zatwierdzanych pozycji przez CDER (Center for Drug Evaluation and Research) waha się w przedziale 20-60. Do tego dochodzą zatwierdzenia przeprowadzane przez CBER (Center for Biologics Evaluation and Research) Pocieszającym jest fakt, że liczba zaaprobowanych nowych leków w ostatnich 10 latach nie spadła poniżej 30, a w poprzednim roku wyniosła 53. Tym niemniej oznacza to, że na rynek amerykański (największy będący marzeniem polskich i nie tylko biotechów) corocznie wchodzi zaledwie kilkadziesiąt nowych leków. Pokazuję ten wykres, aby uświadomić inwestorom, że droga do sukcesu i setek milionów dolarowych przychodów nie jest prosta, a raczej składa się z wielu zakrętów. Mamy tysiące firm biotechnologicznych na świecie i założenie, że każda z nich osiągnie sukces (przyjmijmy że będzie nim zatwierdzenie leku) jest delikatnie mówiąc dość optymistyczne.
Niniejszy artykuł jest drugim z serii dotyczącym biotechnologii na giełdzie. W kolejnym postaram opisać się jaką drogę musi przebyć cząsteczka (kandydat na lek), aby uzyskać zgodę regulatorów i zostać dopuszczoną do sprzedaży. Dużo miejsca poświęcę prawdopodobieństwu przejścia kolejnych etapów rozwoju leku, ponieważ jest to istotny czynnik wpływający na wycenę spółek biotechnologicznych. Jednocześnie wciąż będę przypominał i zwracał uwagę na ryzyka, a także rafy i problemy, które mogą stanąć na drodze inwestorów zainteresowanych spółkami biotechnologicznymi.
Zobacz także:
>> Biotechnologia na giełdzie. Czy drobni inwestorzy mają tu szansę na wielkie zyski?
>> Biotechnologia na giełdzie. Partner to podstawa
>> Biotechnologia na giełdzie. Rozwój leku i prawdopodobieństwo sukcesu
>> Wskaźniki i wyceny spółek biotechnologicznych na GPW
>> Wskaźniki i wyceny giełdowych producentów leków























